2021-2022學年北京理工大附中高二(上)期中化學試卷
發布:2024/11/14 9:0:2
一、選擇題(每題只有一個選項符合題意,每題2分)
-
1.下列做法的目的與改變化學反應速率無關的是( )
A.在糕點包裝內放置小包除氧劑 B.在糖果制作過程中添加著色劑 C.高爐煉鐵前先將鐵礦石粉碎 D.牛奶在冰箱里保存 組卷:36引用:5難度:0.5 -
2.2mol NH3和3mol O2在2L密閉容器中發生反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g),2min后達到平衡,生成1.5mol NO.下列有關說法正確的是( )
A.達到平衡時,4υ正(O2)=5υ逆(NO) B.若單位時間內生成x mol NO,同時消耗x mol NH3,則反應達到平衡狀態 C.達到平衡時,若增加容器體積,則υ正減少,υ逆增大 D.2min內用NH3表示的反應速率為υ(NH3)=0.75mol?L-1?min-1 組卷:28引用:7難度:0.7 -
3.下列熱化學方程式正確的是( )
A.H2的燃燒熱為a kJ?mol-1 H2+Cl2 2HCl△H=-a kJ?mol-1點燃B.1 mol SO2、0.5 mol O2完全反應后,放出熱量98.3 kJ2SO2(g)+O2(g)═2SO3(g)△H=-98.3 kJ?mol-1 C.H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1
H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1D.31 g白磷比31 g紅磷能量多b kJ P4(s)═4P(s)△H=-4b kJ?mol-1 組卷:150引用:17難度:0.6 -
4.一定量的鐵粉和水蒸氣在一個容積可變的密閉容器中進行反應:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)。下列條件能使該反應的化學反應速率增大的是( )高溫A.增加鐵粉的質量 B.保持體積不變,充入N2,使體系壓強增大 C.將容器的體積縮小一半 D.保持壓強不變,充入N2,使容器的體積增大 組卷:139引用:7難度:0.5 -
5.下列說法不正確的是( )
A.ΔH<0、ΔS>0的反應在任何溫度下都能自發進行 B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ?mol-1能自發進行,原因是體系有自發地向混亂度增加的方向轉變的傾向 C.因為焓變和熵變都與反應的自發性有關,因此焓變或熵變均可以單獨作為反應自發性的判據 D.對于同一物質來講,熵值的大小與其狀態有關,固態物質的熵值通常最小 組卷:37引用:4難度:0.7 -
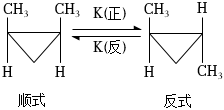 6.順-1,2-二甲基環丙烷和反-1,2-二甲基環丙烷可發生如圖轉化,該反應的速率方程可表示為v正=k正?c順和v逆=k逆?c反,k正和k逆分別是正、逆反應速率常數,它們受溫度的影響。下列有關說法正確的是( )
6.順-1,2-二甲基環丙烷和反-1,2-二甲基環丙烷可發生如圖轉化,該反應的速率方程可表示為v正=k正?c順和v逆=k逆?c反,k正和k逆分別是正、逆反應速率常數,它們受溫度的影響。下列有關說法正確的是( )A.該反應的平衡常數K可能為0 B.某溫度時,該反應的平衡常數可表示為K=k正/k逆 C.正、逆反應速率常數改變,平衡常數也一定會隨之改變 D.溫度降低,k正增大,k逆減小 組卷:20引用:4難度:0.7 -
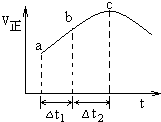 7.向絕熱恒容密閉容器中通入SO2和NO2,一定條件下使反應SO2(g)+NO2(g)?SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示。由圖可得出的正確結論是( )
7.向絕熱恒容密閉容器中通入SO2和NO2,一定條件下使反應SO2(g)+NO2(g)?SO3(g)+NO(g)達到平衡,正反應速率隨時間變化的示意圖如圖所示。由圖可得出的正確結論是( )A.反應在c點達到平衡狀態 B.反應物濃度:a點小于b點 C.反應物的總能量低于生成物的總能量 D.△t1=△t2時,SO2的轉化率:a~b段小于b~c段 組卷:1450引用:111難度:0.5 -
8.對于平衡體系 mA(g)+nB(g)?pC(g)+qD(g) ΔH<0.下列結論中不正確的是( )
A.溫度不變,將容器的體積縮小到原來的一半,此時 A 的濃度為原來的1.5倍,則 m+n>p+q B.若溫度不變時,壓強增大到原來的 2 倍,達到新平衡時,氣體總濃度一定比原來的 2 倍要大 C.若平衡時,A、B 的轉化率相等,說明反應開始時,A、B 的物質的量之比為 m:n D.若 m+n>p+q,mmolA與nmolB 反應達到平衡,A 的轉化率為 a1;2mmolA 與2nmolB 反應達到平衡,A 的轉化率為大于 a1 組卷:40引用:2難度:0.5 -
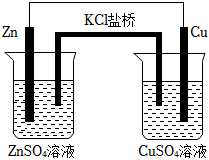 9.關于如圖裝置的說法,錯誤的是( )
9.關于如圖裝置的說法,錯誤的是( )A.鹽橋內的 K+移向CuSO4溶液 B.若將 Cu 電極換成石墨電極,原電池反應不改變 C.銅電極上發生的電極反應是 2H++e-=H2↑ D.Zn為電池的負極 組卷:66引用:3難度:0.5 -
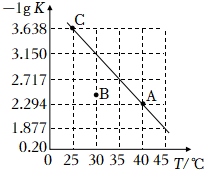 10.將一定量氨基甲酸銨(NH2COONH4)加入密閉容器中,發生反應NH2COONH4(s)?2NH3(g)+CO2(g)。該反應的平衡常數的負對數(-lgK)值隨溫度(T)的變化曲線如圖所示,下列說法不正確的是( )
10.將一定量氨基甲酸銨(NH2COONH4)加入密閉容器中,發生反應NH2COONH4(s)?2NH3(g)+CO2(g)。該反應的平衡常數的負對數(-lgK)值隨溫度(T)的變化曲線如圖所示,下列說法不正確的是( )A.該反應的ΔH>0 B.A點對應狀態的平衡常數K(A)=10-2.294 C.NH3的體積分數不變時,該反應一定達到平衡狀態 D.30℃時,B點對應狀態的v正<v逆 組卷:103引用:4難度:0.5
二、填空題
-
29.二甲醚(DME)被譽為“21世紀的清潔燃料”。由合成氣制備二甲醚的主要原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ?mol-1
回答下列問題:
(1)則反應3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)ΔH=。
(2)以下說法能說明反應3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)達到平衡狀態的有。
A.CO和CH3OCH3的濃度之比保持3:1不變
B.單位時間內斷裂3個H-H同時斷裂1個C=O
C.恒溫恒容條件下,氣體的密度保持不變
D.恒溫恒壓條件下,氣體的平均摩爾質量保持不變
(3)如圖1所示裝置,裝置A是二甲醚燃料電池,該裝置工作時電子從b極流向Fe電極。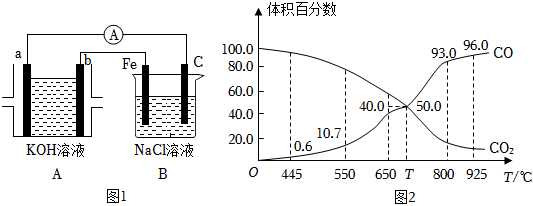
①A池中b電極反應式為。
②若裝置B中溶液體積為300mL,假設反應前后溶液體積不變,當裝置A中消耗0.0025mol二甲醚時,裝置B中溶液的pH為。
(4)一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2?2CO(g),平衡時,體系中氣體體積分數與溫度的關系如圖2所示:(已知氣體分壓(p分)=氣體總壓(p總)×體積分數)
①該反應△H(填“>”、“<”或“=”)0,550℃時,平衡后若充入惰性氣體,平衡。(填“正移”“逆移”或“不移動”)
②650℃時,反應達平衡后CO2的轉化率為。(保留2位有效數字)
③T℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=p總。組卷:33引用:2難度:0.5 -
30.煤制天然氣的工藝流程簡圖如圖1:
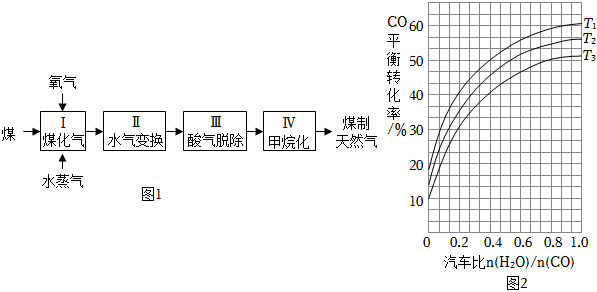
(1)反應I:C(s)+H2O(g)?CO(g)+H2(g)△H=+135kJ?mol-1,通入的氧氣會與部分碳發生燃燒反應.請利用能量轉化及平衡移動原理說明通入氧氣的作用:.
(2)反應II:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ?mol-1.如圖2表示不同溫度條件下,煤氣化反應I發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系.
①判斷T1、T2和T3的大小關系:.(從小到大的順序)
②若煤氣化反應I發生后的汽氣比為0.8,經煤氣化反應I和水氣變換反應II后,得到CO與H2的物質的量之比為1:3,則反應II應選擇的溫度是(填“T1”或“T2”或“T3”).
(3)①甲烷化反應IV發生之前需要進行脫酸反應Ⅲ煤經反應I和II后的氣體中含有兩種酸性氣體,分別是H2S和.
②工業上常用熱碳酸鉀溶液脫除H2S氣體得到兩種酸式鹽,該反應的離子方程式是.組卷:27引用:5難度:0.5


