2020-2021學年山西省朔州市懷仁市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共24小題,每小題2分,滿分48分)
-
1.下列過程符合△H<0的是( )
(已知: )
)A.H2(g)=2H(g) B.C(金剛石s)=C(石墨s) C.NH3?H2O電離 D.CH3COOONa水解 組卷:7引用:1難度:0.7 -
2.下列反應條件的控制中不恰當的是( )
A.為防止鐵生銹,在其表面涂一層防銹油漆 B.為加快稀鹽酸與NaOH的反應速率,加入更多同濃度的稀鹽酸 C.為加快KClO3的分解速率,加入MnO2 D.為防止火災,在面粉廠要嚴禁煙火 組卷:21引用:2難度:0.7 -
3.熱化學硫碘循環硫化氫分解聯產氫氣、硫磺是能源研究領域的重要課題。根據如圖所給數據,下列說法正確的是( )

A.圖1反應若使用催化劑,既可以改變反應路徑,也可以改變其△H B.圖2中若H2O的狀態為氣態,則能量變化曲線可能為① C.圖3反應中反應物的總能量比生成物的總能量高 D.由圖1、圖2和圖3可知,H2S(g)═H2(g)+S(s)△H=+20kJ?mol-1 組卷:147引用:4難度:0.5 -
4.反應①Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,
反應②Fe(s)+H2O(g)?FeO(s)+H2(g)△H<0.
若反應①在溫度T1下進行,反應②在溫度T2下進行,已知T1>T2(其他條件均相同),下面對兩者反應速率大小判斷正確的是( )A.反應①快 B.反應②快 C.一樣大 D.無法判斷 組卷:53引用:7難度:0.9 -
5.下列實驗誤差分析錯誤的是( )
A.用潤濕的pH試紙測稀堿溶液的pH,測定值偏小 B.用標準濃度的NaOH溶液滴定未知濃度的鹽酸時,堿式滴定管滴定前尖端有氣泡,滴定后氣泡消失,會使鹽酸濃度偏小 C.測定中和反應的反應熱時,若保溫措施不好,所測溫度差值偏小 D.測定中和反應的反應熱時,將堿溶液緩慢倒入酸溶液中,所測溫度差值偏小 組卷:134引用:2難度:0.5 -
6.下列事實不能用化學平衡移動原理解釋的是( )
A.向AgCl濁液中加入少量KI溶液,可看到白色沉淀變為黃色沉淀 B.高壓比常壓更有利于N2和H2轉化為NH3 C.蒸干AlCl3溶液無法得到無水AlCl3 D.滴加少量CuSO4溶液可以加快Zn與稀H2SO4反應的速率 組卷:22引用:3難度:0.6 -
7.某溶液改變一個條件,酸性一定增大的是( )
A.由SO2導致的酸雨在空氣中放置一段時間 B.使溶液中c(H+)增大 C.使溶液中c(OH-)減小 D.稀鹽酸露置于空氣中 組卷:60引用:1難度:0.6 -
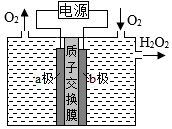 8.采用惰性電極,以去離子水和氧氣為原料通過電解法制備雙氧水的裝置如圖所示。忽略溫度變化的影響,下列說法錯誤的是( )
8.采用惰性電極,以去離子水和氧氣為原料通過電解法制備雙氧水的裝置如圖所示。忽略溫度變化的影響,下列說法錯誤的是( )A.陽極反應為2H2O-4e-═4H++O2↑ B.電解一段時間后,陽極室的pH未變 C.電解過程中,H+由a極區向b極區遷移 D.電解一段時間后,a極生成的O2與b極反應的O2等量 組卷:1076引用:28難度:0.5 -
 9.在恒溫密閉容器中發生反應:CaCO3(s)?CaO(s)+CO2(g)△H>0,反應達到平衡后,tl時縮小容器體積,t1隨時間(t)變化的關系如圖所示。x不可能是( )
9.在恒溫密閉容器中發生反應:CaCO3(s)?CaO(s)+CO2(g)△H>0,反應達到平衡后,tl時縮小容器體積,t1隨時間(t)變化的關系如圖所示。x不可能是( )A.v逆(逆反應速率) B.ρ(容器內氣體密度) C.m(容器內CaO質量) D.Qc(濃度商) 組卷:168引用:5難度:0.4
二、解答題(共4小題,滿分52分)
-
27.鋁是應用廣泛的金屬。以鋁土礦(主要成分為Al2O3,含SiO2和Fe2O3等雜質)為原料制備鋁的一種工藝流程如圖1。

注:SiO2在“堿溶”時轉化為鋁硅酸鈉沉淀。
(1)加快“堿溶”速率的措施有、(至少列舉2種)。
(2)向“過濾Ⅰ”所得濾液中加入NaHCO3溶液,溶液的pH。(填“增大”、“不變”或“減小”)
(3)寫出“電解Ⅰ”的化學方程。
(4)“電解Ⅱ”是電解Na2CO3溶液,原理如圖2所示。A的化學式為,交換膜是(填“陰”或“陽”)離子交換膜。
(5)以甲醇為燃料的新型電池,可做電解熔融氧化鋁過程中的電源,使其成本降低,目前得到廣泛的研究,如圖3是目前研究較多的一類固體氧化物燃料電池工作原理示意圖。
①B極上的電極反應式為。
②若用該燃料電池做電源,用石墨做電極電解硫酸銅溶液,若陰極產物只有銅,要使溶液復原,可向電解后的溶液中加入的物質有。組卷:5引用:1難度:0.5 -
28.氮、磷元素形成的單質和化合物在生產、生活中具有廣泛的應用,對它們的研究具有重要的價值和意義。
已知:Ⅰ.N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
Ⅱ.2NO(g)+O2(g)═2NO2(g)△H=-167.7kJ?mol-1
Ⅲ.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-809.6kJ?mol-1
回答下列問題:
(1)在熱力學上反應Ⅱ比反應Ⅰ趨勢更大,原因是。
(2)研究發現反應Ⅱ分兩步進行:
第一步:2NO(g)═N2O2(g)△H<0快反應;
第二步:N2O2(g)+O2(g)═2NO2(g)△H<0慢反應;
下列有關敘述正確的是。
A.反應速率:v(第一步)>v(第二步)
B.活化能:E(第一步)>E(第二步)
C.決定反應Ⅱ速率快慢的步驟為第二步
D.若第二步的v正=k正c(N2O2)?c(O2)、v逆=k逆c2(NO2),則第二步的平衡常數K=K正?K逆
(3)將NH3與O2按體積比4:5充入體積不變的容器中,起始體系總壓強為45kPa,分別在催化劑M、N作用下發生反應Ⅲ,NO的分壓(p)與反應時間(t)和溫度(T)的關系如圖:由圖象可判斷反應溫度:T1T2(填“>”、“<”或“=”,下同),催化劑效率:催化劑M催化劑N,T1℃時,在催化劑M作用下,0~10min內的平均反應速率v[NH3(g)]=kPa?min-1。
(4)已知H3PO2(次磷酸)與足量的NaOH反應只生成一種鹽NaH2PO2。H3PO2水溶液中存在H3PO2分子。
①NaH2PO2是。(填“正鹽”、“酸式鹽”或“堿式鹽”)
②向H3PO2溶液中逐滴加入等濃度的NaOH溶液至過量,其導電性變化圖象為;向稀NaOH溶液中逐滴滴加濃H3PO2溶液至恰好中和,其導電性變化圖象為。 組卷:4引用:1難度:0.5
組卷:4引用:1難度:0.5


