2021-2022學年湖北省武漢市洪山區長虹中學高二(上)月考化學試卷(10月份)
發布:2024/4/20 14:35:0
一、選擇題(本題共15小題,每小題3分,共45分。在每小題給出的四個選項中,只有一項符合題目要求)
-
1.合成氨工業上采用循環操作主要是因為( )
A.增大化學反應速率 B.提高平衡混合物中NH3的含量 C.提高N2和H2的利用率 D.降低NH3的沸點 組卷:48引用:2難度:0.5 -
 2.一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)?2CO(g),平衡時,體系中氣體體積分數與溫度的關系如圖所示,已知:氣體分壓(p分)=氣體總壓(p總)×體積分數。下列說法正確的是( )
2.一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)?2CO(g),平衡時,體系中氣體體積分數與溫度的關系如圖所示,已知:氣體分壓(p分)=氣體總壓(p總)×體積分數。下列說法正確的是( )A.550℃時,若充入惰性氣體,v正、v逆均減小,平衡不移動 B.650℃時,反應達平衡后CO2的轉化率為50.0% C.T℃時,若充入等體積的CO2和CO,平衡不移動 D.925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=50.0p總 組卷:27引用:4難度:0.4 -
3.一定溫度下,某容器中加入足量碳酸鈣,發生反應CaCO3(s)?CaO(s)+CO2(g)達到平衡。下列說法正確的是( )
A.將體積縮小為原來的一半,當體系再次達到平衡時,CO2的濃度為原來的2倍 B.CaCO3(s)加熱分解生成CaO(s)和CO2(g)△H<0 C.將體積增大為原來的2倍,再次達到平衡時,氣體密度不變 D.保持容器體積不變,充入He,平衡向逆反應方向移動 組卷:12引用:1難度:0.7 -
4.根據Ca(OH)2/CaO體系的能量循環圖,下列說法正確的是( )
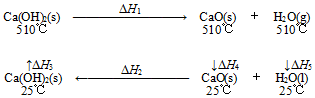
A.△H5>0 B.△H1+△H2=0 C.△H3=△H4+△H5 D.△H1+△H2+△H3+△H4+△H5=0 組卷:101引用:13難度:0.5 -
5.在一定體積的密閉容器中,進行反應:2X(g)+Y(s)?Z(g)+W(g) ΔH=akJ?mol-1,若其化學平衡常數K和溫度t的關系如表。下列敘述正確的是( )
t/℃ 700 800 900 1000 1200 K 0.6 1.0 1.3 1.8 2.7 A.a<0 B.該反應的化學平衡常數表達式為:K= c(Z)?c(W)c2(X)?c(Y)C.若在1L容器中通X和Y各0.3mol,在800℃下反應,某時刻測得X的物質的量為0.1mol,說明該反應已達平衡 D.在1000℃時,反應Z+W?2X+Y的平衡常數為1.8 組卷:33引用:2難度:0.4 -
6.下列熱化學方程式或離子方程式中,正確的是( )
A.0.01mol?L-1KAl(SO4)2溶液與0.02mol?L-1Ba(OH)2溶液等體積混合:Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ B.一定條件下,將0.5mol N2(g)和1.5molH2(g)置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,熱化學方程式為:N2(g)+3H2(g)?2NH3(g)ΔH=-38.6kJ/mol C.2H2(g)+O2(g)═2H2O(g)ΔH=-571.6 kJ?mol-1,則H2的燃燒熱為285.8 kJ/mol D.CO(g)的燃燒熱是283.0 kJ?mol-1,則CO2分解的熱化學方程式為:2CO2(g)═2CO(g)+O2(g)ΔH=+566.0 kJ/mol 組卷:10引用:2難度:0.5
二、非選擇題(本題共4小題,共55分)
-
 18.甲醚又稱二甲醚,被譽為“21世紀的清潔燃料”。由合成氣(CO、H2)制備二甲醚的反應原理如下:
18.甲醚又稱二甲醚,被譽為“21世紀的清潔燃料”。由合成氣(CO、H2)制備二甲醚的反應原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.0kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g) ΔH2
回答下列問題:
(1)若由合成氣(CO、H2)制備1molCH3OCH3(g),且生成H2O(l),整個過程中放出的熱量為244kJ,則ΔH2=kJ?mol-1。【已知:H2O(l)=H2O(g)ΔH═+44.0kJ?mol-1】
(2)有人模擬該制備原理,500K時,在2L的密閉容器中充入2molCO和6molH2,5min達到平衡,平衡時CO的轉化率為60%,c(CH3OCH3)=0.2mol?L-1,用H2表示反應①的速率是mol?L-1?min-1,可逆反應②的平衡常數K2=。若在500K時,測得容器中n(CH3OCH3)=2n(CH3OH),此時反應②的v正v逆(填“>”“<”或“=”)。
(3)在體積一定的密閉容器中發生反應②,如果該反應的平衡常數K2值變小,下列說法正確的是。
A.在平衡移動過程中逆反應速率先增大后減小
B.容器中CH3OCH3的體積分數增大
C.容器中混合氣體的平均相對分子質量減小
D.達到新平衡后體系的壓強增大
(4)一定條件下在恒溫恒容的密閉容器中,按不同投料比充入CO(g)和H2(g)進行反應①,平衡時CO(g)和H2(g)的轉化率如圖所示,則a=(填數值)。
(5)甲醇液相脫水法制二甲醚的原理是:CH3OH+H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4,與合成氣制備二甲醚比較,該工藝的優點是反應溫度低,轉化率高,其缺點是。組卷:5引用:1難度:0.4 -
 19.霧霾嚴重影響人們的生活,汽車尾氣的排放是造成霧霾天氣的重要原因之一、已知汽車尾氣排放時容易發生以下反應:
19.霧霾嚴重影響人們的生活,汽車尾氣的排放是造成霧霾天氣的重要原因之一、已知汽車尾氣排放時容易發生以下反應:
①N2(g)+O2(g)?2NO(g)△H1=akJ?mol-1
②CO(g)+O2(g)?CO2(g)△H2=bkJ?mol-112
③2CO(g)+2NO(g)?N2(g)+2CO2(g) ΔH3
請回答下列問題:
(1)ΔH3=kJ?mol-1(用含a、b的代數式表示)。
(2)能說明反應③已達平衡狀態的標志是(填字母)。
A.單位時間內生成1molCO2的同時消耗了1molCO
B.在恒溫恒容的容器中,混合氣體的密度保持不變
C.在絕熱恒容的容器中,反應的平衡常數不再變化
D.在恒溫恒壓的容器中,NO的體積分數保持不變
(3)在一定溫度下,向體積為VL的恒容密閉容器中充入一定量的NO和CO,發生反應③。在t1時刻達到平衡,此時n(CO)=xmol,n(NO)=2xmol,n(N2)=ymol,則NO的平衡轉化率為(用含x、y的代數式表示);再向容器中充入ymolCO2和xmolNO,則此時v(正)v(逆)(填“>”、“<”或“=”)。
(4)煙氣中也含有氮氧化物,C2H4可用于煙氣脫硝。為研究溫度、催化劑中Cu2+負載量對NO去除率的影響,控制其它條件一定,實驗結果如圖所示。為達到最高的NO去除率,應選擇的反應溫度約為,Cu2+負載量為。組卷:10引用:1難度:0.3


