2021年江蘇省高考化學適應性試卷(2)
發布:2024/4/20 14:35:0
一.選擇題(共10小題,滿分20分,每小題2分)
-
1.關于維生素的下列說法不正確的是( )
A.維生素是生物生長發育和新陳代謝所必需的物質 B.按溶解性的不同,維生素可分為脂溶性維生素和水溶性維生素兩類 C.缺乏維生素A易患甲狀腺腫大 D.缺乏維生素C易患壞血病 組卷:43引用:2難度:0.9 -
2.下列推斷正確的是( )
A.BF3是三角錐形分子 B.NH4+的電子式:  ,離子呈平面形結構
,離子呈平面形結構C.CH4分子中的4個C-H鍵都是氫原子的1s軌道與碳原子的p軌道形成的s-pσ鍵 D.CH4分子中的碳原子以4個sp3雜化軌道分別與4個氫原子的1s軌道重疊,形成4個C-Hσ鍵 組卷:119引用:9難度:0.9 -
3.化學與生活息息相關,下列有關說法正確的是( )
A.纖維素屬于營養物質,在人體內消化產生葡萄糖 B.醫用酒精的體積分數通常為75% C.乙烯、乙酸的所有原子都在同一平面上 D.高級脂肪酸乙酯是生物柴油的一種成分,它屬于油脂,一定能使溴水褪色 組卷:112引用:2難度:0.7 -
4.下列各組離子在選項條件下一定能大量共存的是( )
A.無色溶液:Na+、Cu2+、Cl-、NO3- B.酸性溶液:NH4+、Fe3+、S2-、SO42- C.遇酚酞變紅的溶液:Na+、K+、SO42-、NO3- D.堿性溶液:K+、Al3+、SO42-、NO3- 組卷:618引用:19難度:0.6 -
5.以含鈷廢渣(主要成分CoO、Co2O3,還含有Al2O3、ZnO等雜質)為原料制備Co2O3的一種實驗流程如圖。下列與流程相關的裝置和原理能達到實驗目的的是( )
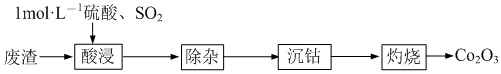
A. 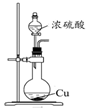
制備“酸浸”所需的SO2B. 
配制“酸浸”所需的1mol?L-1H2SO4溶液C. 
過濾“沉鈷”所得懸濁液D. 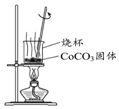
灼燒CoCO3固體制Co2O3組卷:70引用:7難度:0.5 -
6.下列單質既能跟氯氣直接反應,又能跟稀鹽酸反應,且產物不相同的是( )
A.Al B.Cu C.Fe D.Zn 組卷:280引用:18難度:0.7
三.解答題(共5小題,滿分60分,每小題12分)
-
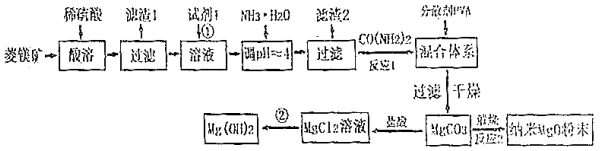
19.工業上以菱鎂礦(主要成分為MgCO3,含少量FeCO3、SiO2)為原料制備金屬鎂的實驗流程如圖:
已知:一些金屬離子轉化為氫氧化物沉淀時,溶液的pH如表所示
請回答:Fe3+ Fe2+ Mg2+ 開始沉淀時 1.5 6.5 9.4 完全沉淀時 3.7 9.7
(1)過程①加入試劑1的目的為,濾渣2的主要成分為。
(2)反應1中生成MgCO3的化學方程式:。
(3)當殘留在溶液中的離子濃度為1.00×10-5mol?L-1時就認為沉淀完全,為保證Mg2+沉淀完全,過程②中
控制溶液的pH至少為。(已知該溫度下Mg(OH)2的Ksp=2.00×10-11,lg2=0.30)。
(4)工業上還可用氯化鎂和碳酸銨為原料,直接制備納米MgO.如圖為反應溫度對納米MgO產率和粒徑的影
響,根據圖象分析,制備粒徑為30~70納米的MgO,選擇反應的最佳溫度為℃。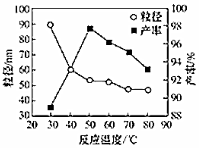
(5)為測定菱鎂礦中鐵的含量,分別稱取12.5g菱鎂礦樣品溶于過量的稀稀硫完全轉移到錐形瓶中,加入指
示劑,用0.010mol?L-1H2O2溶液進行滴定,平行測定4組,消耗H2O2溶液的體積數據記錄如表所示。
①根據表中數據,可計算出菱鐵礦中鐵的質量分數為實驗編號 1 2 3 4 消耗H2O2溶液的體積/mL 15.00 15.02 15.62 14.98 %(保留兩位小數)
②H2O2溶液應裝在滴定管中(填“酸式”或“堿式“)。
③誤差分析:其他操作均正確,滴定終點時俯視讀數會導致所測結果。組卷:28引用:2難度:0.5 -
20.乙烯是世界上產量最大的化學品之一,是石油化工產業的核心。其制備方法在不斷的優化,以乙烷為原料制備乙烯,成本較低。
(1)傳統制備方法:乙烷催化裂解法發生的反應為:C2H6(g)?C2H4(g)+H2(g)△H
①已知:298K時,相關物質的相對能量如圖1。則△H=。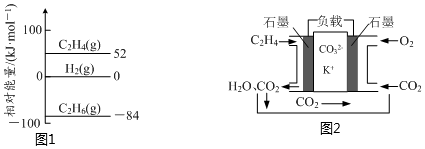
②850℃,恒壓條件下,常需要通入大量水蒸氣,目的是。
(2)乙烷氧化裂解制乙烯[主反應為C2H6(g)+O2(g)?C2H4(g)+H2O(g)]12
①“乙烷催化裂解法”制備乙烯時,常會發生積碳反應:C2H6(g)?2C(s)+3H2(g),生成的碳會附著在催化劑的表面,降低催化劑的活性,而“乙烷氧化裂解制乙烯”時,很少有積碳,可能原因是。
②探究該反應的適宜條件,得到如圖數據。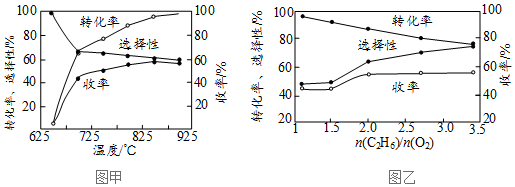
已知:C2H4的選擇性:指轉化的C2H6中生成C2H4的百分比;乙烯的收率=C2H6的轉化率×C2H4的選擇性。
圖甲:表示其它條件相同,不同溫度條件下,組成相同的原料氣,反應相同的時間,測得的C2H6的轉化率、C2H4的選擇性以及乙烯的收率與溫度的關系。
圖乙:表示其他條件相同,C2H6的轉化率、C2H4的選擇性以及乙烯的收率隨原料氣中的變化情況。n(C2H6)n(O2)
用該方法制備乙烯應該選擇的適宜條件為:溫度;=n(C2H6)n(O2)。
(3)某乙烯熔融燃料電池工作原理如圖2所示:則負極的電極反應式為。組卷:107引用:3難度:0.7


