魯科版高三(上)高考題單元試卷:第2章 化學(xué)反應(yīng)的方向、限度與速率(01)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共21小題)
-
1.反應(yīng)2SO2+O2?2SO3,經(jīng)一段時間后SO3的濃度增加了0.4mol?L-1,在這段時間內(nèi)用O2表示的反應(yīng)速率為0.4mol?L-1?s-1,則這段時間為( )
A.0.1s B.2.5s C.0.5s D.10s 組卷:1358引用:34難度:0.9 -
2.運用相關(guān)化學(xué)知識進行判斷,下列結(jié)論錯誤的是( )
A.某吸熱反應(yīng)能自發(fā)進行,因此該反應(yīng)是熵增反應(yīng) B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃試劑瓶中 C.可燃冰主要是甲烷與水在低溫高壓下形成的水合物晶體,因此可存在于海底 D.增大反應(yīng)物濃度可加快反應(yīng)速度,因此用濃硫酸與鐵反應(yīng)能增大生成H2的速率 組卷:1316引用:28難度:0.9 -
3.一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應(yīng):C(s)+CO2(g)?2CO(g),平衡時,體系中氣體體積分?jǐn)?shù)與溫度的關(guān)系如圖所示:已知氣體分壓(P分)=氣體總壓(P總)×體積分?jǐn)?shù),下列說法正確的是( )
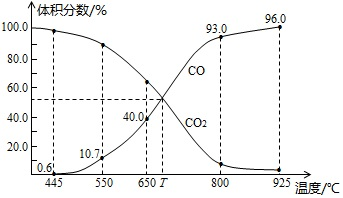
A.550℃時,若充入惰性氣體,v正,v逆均減小,平衡不移動 B.650℃時,反應(yīng)達(dá)平衡后CO2的轉(zhuǎn)化率為25.0% C.T℃時,若充入等體積的CO2和CO,平衡向逆反應(yīng)方向移動 D.925℃時,用平衡分壓代替平衡濃度表示的化學(xué)平衡常數(shù)Kp=24.0P總 組卷:3777引用:97難度:0.5 -
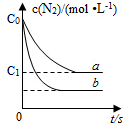 4.等物質(zhì)的量的N2(g)和O2(g)在恒容密閉容器中反應(yīng):N2(g)+O2(g)?2NO(g),下圖曲線a表示該反應(yīng)在T℃時N2的濃度隨時間的變化,曲線b表示該反應(yīng)在某一起始反應(yīng)條件改變時N2的濃度隨時間的變化。下列敘述正確的是( )
4.等物質(zhì)的量的N2(g)和O2(g)在恒容密閉容器中反應(yīng):N2(g)+O2(g)?2NO(g),下圖曲線a表示該反應(yīng)在T℃時N2的濃度隨時間的變化,曲線b表示該反應(yīng)在某一起始反應(yīng)條件改變時N2的濃度隨時間的變化。下列敘述正確的是( )A.T℃時,該反應(yīng)的平衡常數(shù)K= 4(c0-c1)2c12B.T℃時,隨著反應(yīng)的進行,混合氣體的密度減小 C.曲線b對應(yīng)的條件改變可能是加入了催化劑 D.若曲線b對應(yīng)的條件改變是溫度,可判斷該反應(yīng)的△H<0 組卷:4261引用:54難度:0.5 -
5.對于合成氨反應(yīng),達(dá)到平衡后,以下分析正確的是( )
A.升高溫度,對正反應(yīng)的反應(yīng)速率影響更大 B.增大壓強,對正反應(yīng)的反應(yīng)速率影響更大 C.減小反應(yīng)物濃度,對逆反應(yīng)的反應(yīng)速率影響更大 D.加入催化劑,對逆反應(yīng)的反應(yīng)速率影響更大 組卷:804引用:36難度:0.9 -
6.已知反應(yīng)A+3B?2C+D在某段時間內(nèi),以A的濃度變化表示的化學(xué)反應(yīng)速度為1mol?L-1?min-1,則此段時間內(nèi),以C的濃度變化表示的化學(xué)反應(yīng)速率為( )
A.0.5mol?L-1?min-1 B.1mol?L-1?min-1 C.2mol?L-1?min-1 D.3mol?L-1?min-1 組卷:2537引用:47難度:0.9 -
7.合成氨所需的氫氣可用煤和水作原料經(jīng)多步反應(yīng)制得,其中的一步反應(yīng)為:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反應(yīng)達(dá)到平衡后,為提高CO的轉(zhuǎn)化率,下列措施中正確的是( )催化劑A.增加壓強 B.降低溫度 C.增大CO的濃度 D.更換催化劑 組卷:990引用:90難度:0.9 -
8.一定量的鹽酸跟過量的鐵粉反應(yīng)時,為了減緩反應(yīng)速度,且不影響生成氫氣的總量,可向鹽酸中加入適量的( )
A.NaOH(固體) B.H2O C.NH4Cl(固體) D.CH3COONa(固體) 組卷:521引用:12難度:0.7 -
9.下列說法正確的是( )
A.可逆反應(yīng)的特征是正反應(yīng)速度總是和逆反應(yīng)速度相等 B.在其它條件不變時,使用催化劑只能改變反應(yīng)速度,而不能改變化學(xué)平衡狀態(tài) C.在其它條件不變時,升高溫度可以使化學(xué)平衡向吸熱反應(yīng)的方向移動 D.在其它條件不變時,增大壓強一定會破壞氣體反應(yīng)的平衡狀態(tài) 組卷:236引用:18難度:0.9 -
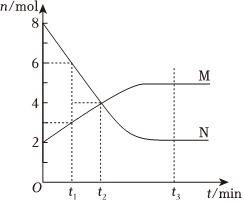 10.在一定溫度下,容器內(nèi)某一反應(yīng)中M、N的物質(zhì)的量隨反應(yīng)時間變化的曲線如圖,下列表述中正確的是( )
10.在一定溫度下,容器內(nèi)某一反應(yīng)中M、N的物質(zhì)的量隨反應(yīng)時間變化的曲線如圖,下列表述中正確的是( )A.反應(yīng)的化學(xué)方程式為:2M?N B.t2時,正逆反應(yīng)速率相等,達(dá)到平衡 C.t3時,正反應(yīng)速率大于逆反應(yīng)速率 D.t1時,N的濃度是M濃度的2倍 組卷:765引用:157難度:0.9
二、解答題(共9小題)
-
29.合成氨是人類科學(xué)技術(shù)上的一項重大突破,其反應(yīng)原理為:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol ̄1
一種工業(yè)合成氨的簡易流程圖如圖1: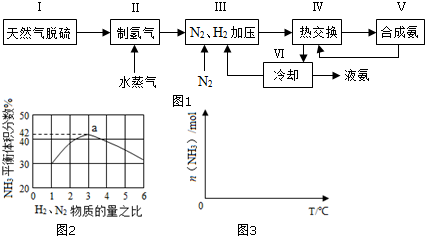
(1)天然氣中的H2S雜質(zhì)常用常用氨水吸收,產(chǎn)物為NH4HS.一定條件下向NH4HS溶液中通入空氣,得到單質(zhì)硫并使吸收液再生,寫出再生反應(yīng)的化學(xué)方程式:.
(2)步驟II中制氯氣原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g)△H=+206.4kJ?mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ?mol-1
對于反應(yīng)①,一定可以提高平衡體系中H2百分含量,又能加快反應(yīng)速率的是.
a.升高溫度 b.增大水蒸氣濃度 c.加入催化劑 d.降低壓強
利用反應(yīng)②,將CO進一步轉(zhuǎn)化,可提高H2產(chǎn)量.若1mol CO和H2的混合氣體(CO的體積分?jǐn)?shù)為20%)與H2O反應(yīng),得到1.18mol CO、CO2和H2的混合氣體,則CO轉(zhuǎn)化率為.
(3)圖2表示500℃、60.0MPa條件下,原料氣投料比與平衡時NH3體積分?jǐn)?shù)的關(guān)系.根據(jù)圖中a點數(shù)據(jù)計算N2的平衡體積分?jǐn)?shù):.
(4)依據(jù)溫度對合成氨反應(yīng)的影響,在圖3坐標(biāo)系中,畫出一定條件下的密閉容器內(nèi),從通入原料氣開始,隨溫度不斷升高,NH3物質(zhì)的量變化的曲線示意圖.
(5)上述流程圖中,使合成氨放出的熱量得到充分利用的主要步驟是(填序號),簡述本流程中提高合成氨原料總轉(zhuǎn)化率的方法:.組卷:546引用:28難度:0.3 -
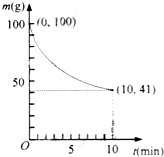 30.鎳具有優(yōu)良的物理和化學(xué)特性,是許多領(lǐng)域尤其是高技術(shù)產(chǎn)業(yè)的重要原料.羰基法提純粗鎳涉及的兩步反應(yīng)依次為:
30.鎳具有優(yōu)良的物理和化學(xué)特性,是許多領(lǐng)域尤其是高技術(shù)產(chǎn)業(yè)的重要原料.羰基法提純粗鎳涉及的兩步反應(yīng)依次為:
①Ni(S)+4CO(g)Ni(CO)4(g)+Q;50℃
②Ni(CO)4(g)Ni(S)+4CO(g)完成下列填空:230℃
(1)在溫度不變的情況下,要提高反應(yīng)(1)中Ni(CO)4的產(chǎn)率,可采取的措施有、.
(2)已知在一定條件下的2L密閉容器中制備Ni(CO)4,粗鎳(純度98.5%,所含雜質(zhì)不與CO反應(yīng))剩余質(zhì)量和反應(yīng)時間的關(guān)系如圖所示.Ni(CO)4在0~10min的平均反應(yīng)速率為.
(3)若反應(yīng)(2)達(dá)到平衡后,保持其他條件不變,降低溫度,重新達(dá)到平衡時.
a.平衡常數(shù)K增大 b.CO的濃度減小
c.Ni的質(zhì)量減小 d.v逆[Ni(CO)4]增大.
(4)簡述羰基法提純粗鎳的操作過程:.組卷:641引用:15難度:0.1


