2016-2017學年遼寧省大連市莊河高級中學高三(上)開學化學試卷(9月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共7小題,每小題3分,滿分21分)
-
1.下列物質的用途利用了其還原性的是( )
A.用金屬鋁進行鋁熱法煉鐵 B.用熟石灰中和土壤的酸性 C.用NaHCO3治療胃酸過多 D.用水玻璃制備硅膠和木材防火劑 組卷:22引用:2難度:0.9 -
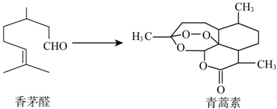 2.中國科學家屠呦呦因為創(chuàng)制了新型抗瘧疾-青蒿素,獲得2015年諾貝爾獎.青蒿素可由香茅醛為原料制取,下列說法錯誤的是( )
2.中國科學家屠呦呦因為創(chuàng)制了新型抗瘧疾-青蒿素,獲得2015年諾貝爾獎.青蒿素可由香茅醛為原料制取,下列說法錯誤的是( )A.香茅醛能使Br2的CCl4溶液褪色 B.青蒿素分子式為C15H22O5 C.青蒿素含有和H2O2相同的過氧鍵 D.青蒿素能與氫氣發(fā)生加成反應 組卷:14引用:3難度:0.9 -
3.五種短周期主族元素X、Y、Z、W、R的原子序數依次增大,X是周期表中非金屬性最強的元素;Y是短周期中原子半徑最大的元素;Z是地殼中含量最多的金屬元素;W最外層電子數是K層電子數的3倍.下列說法正確的是( )
A.離子半徑:Y>Z>W>R>X B.氫化物穩(wěn)定性:X>W>R C.Y、Z、W的最高價氧化物對應的水化物兩兩均可互相反應 D.Y與Z不能存在于同一離子化合物中 組卷:15引用:5難度:0.7 -
4.NA代表阿伏加德羅常數的值.下列敘述正確的是( )
A.標準狀況下,2.24L戊烷中存在的共價鍵總數為1.6NA B.23gNO2與N2O4的混合氣體中含有的氮原子數為0.5NA C.過氧化鈉與二氧化碳反應時,生成0.1mol氧氣轉移的電子數為0.4NA D.1L 0.1mol?L-1的NaH2PO4溶液中H2 、PO-4和HPO2-4離子數之和為0.1NAPO3-4組卷:18引用:2難度:0.7
四.【化學--選修3:物質結構與性質】
-
 11.X、Y、Z、W、R是元素周期表前四周期元素中的五種常見元素,其原子序數依次增大.X的基態(tài)原子的最外層電子排布式為nsnnpn+1.Y、Z同主族且ZY2是導致酸雨的主要物質之一.R位于ds區(qū)且原子最外層只有一個電子.W原子次外層電子數為最外層電子數的7倍.請回答下列問題:
11.X、Y、Z、W、R是元素周期表前四周期元素中的五種常見元素,其原子序數依次增大.X的基態(tài)原子的最外層電子排布式為nsnnpn+1.Y、Z同主族且ZY2是導致酸雨的主要物質之一.R位于ds區(qū)且原子最外層只有一個電子.W原子次外層電子數為最外層電子數的7倍.請回答下列問題:
(1)W位于元素周期表第周期族,其基態(tài)原子的核外電子排布式為.
(2)Y的氣態(tài)氫化物的穩(wěn)定性比Z的氣態(tài)氫化物的穩(wěn)定性(填“強”或“弱”).Y的第一電離能比Z的(填“大”或“小”).
(3)X的最常見的氣態(tài)氫化物分子的VSEPR模型為,分子的空間構型是.
(4)原子總數相同、價電子總數相同的分子或離子成為等電子體.分別寫出一種與XO2-互為等電子體的單質和化合物的化學式:、.XO2-的中心原子采用雜化.
(5)[W(CN)6]3-離子中W的陽離子與CN-之間的共價鍵稱為,該化學鍵能夠形成的原因是.
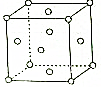
(6)圖是R晶體的晶胞結構示意圖,每個晶胞中含有個R原子.組卷:27引用:3難度:0.1
五.【化學--選修5:有機化學基礎】
-
12.有機物H是一種可降解的聚酯類高分子材料,在材料的生物相容性方面有很好的應用前景.H的一種合成路線如下:

已知:
①有機物G發(fā)生脫水反應的產物能使溴水褪色
②1molG能與3molNa反應
③1molG能與2molNaHCO3反應并產生CO2氣體
回答下列問題:
(1)D中含有的官能團的名稱為,G的結構簡式為.
(2)i的反應類型為,ii的反應類型為.
(3)由A生成B的反應試劑和條件是.
(4)與G具有相同官能團的同分異構體共有種(不含立體異構),其中核磁共振氫譜顯示為3組峰,且峰面積比為3:2:1的是(寫結構簡式).
(5)由E生成F的化學方程式為.
(6)H為G的聚合物,H在生物體內發(fā)生水解反應的化學方程式為.組卷:19引用:4難度:0.5


