2021-2022學年河北省邢臺市五岳聯盟部分重點學校高三(上)期中化學試卷
發布:2024/11/18 11:30:1
一、選擇題:本題共9小題,每小題3分,共27分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學與生活息息相關,下列說法中錯誤的是( )
A.石灰石可用于防止樹木凍傷,并防止害蟲生卵 B.在野外被蚊蟲叮咬時,可在傷口處涂抹肥皂水,以減輕痛癢 C.汽車遠程照燈在前方揚塵上形成光亮的通路,說明混有揚塵的空氣屬于膠體 D.古老的西方煉金術是要“把賤金屬轉化成純金”,他們不能達到目的的原因是違背了質量守恒定律 組卷:58引用:2難度:0.8 -
2.在堿性條件下,溴乙烷可轉化為乙醇:CH3CH2Br+NaOH
CH3CH2OH+NaBr。下列化學用語表示錯誤的是( )水△A.Na+的結構示意圖為 
B.羥基的電子式為 
C.乙醇的比例模型為 
D.溴乙烷的結構式為  組卷:14引用:3難度:0.7
組卷:14引用:3難度:0.7 -
3.下列物質應用正確的是( )
A.泡沫滅火器可用于金屬鈉著火時滅火 B.碳酸鋇可用于胃腸X射線造影檢查 C.用浸泡過高錳酸鉀溶液的硅藻土保鮮水果 D.用淀粉檢驗食鹽中的碘元素 組卷:44引用:3難度:0.6 -
4.下列離子方程式書寫正確的是( )
A.向CuSO4溶液中通入H2S氣體:Cu2++S2-═CuS↓ B.將FeO固體放入稀硝酸中:FeO+2H+═Fe2++H2O C.NaHSO4溶液與Ba(OH)2溶液反應至溶液呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O D.用氨水吸收煙氣中的二氧化硫:SO2+2OH-═SO32-+H2O 組卷:25引用:6難度:0.7 -
5.已知NA為阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,33.6L二氯甲烷中含有氯原子的數目為3NA B.7.8g由Na2O2和Na2S組成的固體混合物中含有的離子總數為0.3NA C.60gCH3COOH與乙醇發生酯化反應,充分反應后斷裂C-O鍵的數目為NA D.常溫下,11.2L由甲烷和乙烯組成的混合物中含氫原子的數目為2NA 組卷:12引用:3難度:0.6
三、非選擇題:本題共4小題,共51分。
-
16.無水四氯化錫(SnCl4)可用于制作導電玻璃,導電玻璃廣泛用于液晶顯示屏、薄膜太陽能電池基底等。可用如圖裝置制備四氯化錫(部分夾持裝置已略去):

有關信息如表:
回答下列問題:化學式 Sn SnCl2 SnCl4 熔點/°C 232 246 -33 沸點/°C 2260 652 114 其他性質 銀白色固體金屬 無色晶體,Sn(Ⅱ)易被Fe3+、I2等氧化成Sn(Ⅳ) 無色液體,易水解
(1)儀器A的名稱為,儀器A中發生反應的離子方程式為。
(2)將裝置如圖連接好之后,首先應進行的操作為,而后慢慢滴入濃鹽酸,待觀察到丁裝置中充滿黃綠色氣體后,開始加熱丁裝置,錫熔化后適當增大氯氣流量并繼續加熱丁裝置。
(3)戊裝置中球形冷凝管的冷水進口為(填“a”或“b”)。
(4)己裝置中堿石灰的作用是。
(5)Cl2和Sn的反應產物可能會有SnCl4和SnCl2,為防止產品中帶入SnCl2,除了通入過量氯氣外,應控制溫度在~℃范圍內。
(6)為了確認丁裝置中有SnCl2生成,可選用以下(填標號)檢驗。
A.稀鹽酸
B.酸性高錳酸鉀溶液
C.加入少量含有KSCN的FeCl3溶液
D.NaOH稀溶液
(7)碘氧化法滴定分析產品中Sn(Ⅱ)的含量。準確稱取mg產品于錐形瓶中,用適量濃鹽酸溶解,淀粉溶液作指示劑,用cmol?L-1碘標準溶液滴定。實驗中達到滴定終點的顏色變化為,若此時消耗碘標準溶液VmL,則產品中Sn(Ⅱ)的質量分數為(用字母表示)。組卷:19引用:4難度:0.6 -
17.研究氮的循環和轉化對生產、生活有重要的價值。
Ⅰ.利用石灰乳和硝酸工業的尾氣(含NO、NO2)反應,既能凈化尾氣,又能獲得應用廣泛的Ca(NO2)2,其部分工藝流程如圖1所示: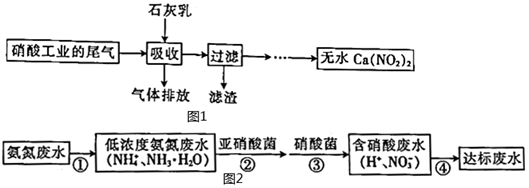
(1)流程中“濾渣”可循環使用,“濾渣”的主要成分是(填化學式)。已知0℃時Ca(NO2)2在水中的溶解度仍然很大,實驗室從Ca(NO2)2溶液得到Ca(NO2)2晶體的操作是。
(2)生產中溶液需保持弱堿性。酸性條件下,Ca(NO2)2溶液會發生反應生成Ca(NO3)2、NO和H2O,該反應的離子方程式為。
Ⅱ.工業上也可用Na2CO3溶液吸收處理氮的氧化物尾氣(NOx)。一定比例的NO和NO2的混合氣體被Na2CO3溶液吸收只生成一種含氧酸鹽和一種無色無味的氣體。
(3)寫出上述反應的離子方程式:。
Ⅲ.氨氮廢水的排放會加速藻類和其他浮游生物的大量繁殖,使水質惡化。利用微生物對氨氮廢水進行處理的流程如圖2。
(4)檢驗某溶液中是否含有的方法是NH+4(寫出所需試劑、操作及現象)。
(5)過程②在空氣中進行,在亞硝酸菌的作用下,轉化為HNO2,寫出該轉化的離子方程式:NH+4。
(6)根據圖3和圖4,判斷使用亞硝酸菌的最佳條件為。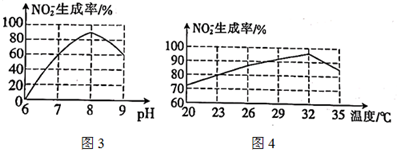
(7)過程②、③:在微生物亞硝酸菌和硝酸菌作用下實現→NH+4→NO-2的轉化,該過程稱為硝化反應。1NO-3可被molNH+4L(標準狀況)O2最終氧化成。NO-3
(8)利用微生物處理氨氮廢水的優點為。組卷:20引用:1難度:0.5


