2020-2021學年湖南師大附中高一(下)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題共16小題,每小題3分,共48分。在每小題只有一項是符合題目要求的)
-
1.下列反應既是氧化還原反應,又是吸熱反應的是( )
A.高溫條件下炭與水蒸氣的反應 B.Ba(OH)2?8H2O與氯化銨反應 C.硫酸與氫氧化鈉的反應 D.氫氣在氧氣中的燃燒反應 組卷:15引用:2難度:0.8 -
2.CO2和CH4催化重整可制備合成氣,對減緩燃料危機具有重要的意義,其反應歷程示意圖如圖:下列說法不正確的是( )
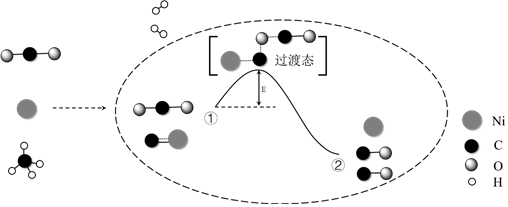
A.合成氣的主要成分為CO和H2 B.①→②既有碳氧鍵的斷裂,又有碳氧鍵的形成 C.①→②吸收能量 D.Ni在該反應中作催化劑 組卷:221引用:16難度:0.6 -
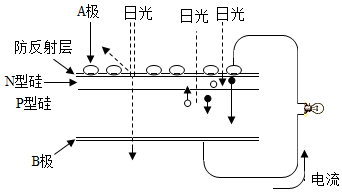 3.可再生能源是我國重要的能源資源,在能源要求、改善能源結構、減少環境污染、促進經濟發展等方面具有重要作用。應用太陽能光伏發電技術是實現節能減排的一項重要措施。下列有關分析不正確的是( )
3.可再生能源是我國重要的能源資源,在能源要求、改善能源結構、減少環境污染、促進經濟發展等方面具有重要作用。應用太陽能光伏發電技術是實現節能減排的一項重要措施。下列有關分析不正確的是( )A.風能、太陽能、生物質能等屬于可再生能源 B.推廣可再生能源有利于經濟可持續發展 C.如圖是太陽能光伏發電原理圖,圖中A極為正極 D.光伏發電能量轉化方式是太陽能直接轉變為電能 組卷:123引用:19難度:0.9 -
4.有a、b、c、d四個金屬電極,有關的實驗裝置及部分實驗現象如下:
由此可判斷這四種金屬的活動性順序是( )實驗裝置 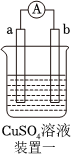
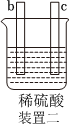
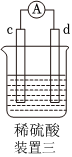
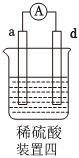
部分實驗現象 a極質量減小,b極質量增大 b極有氣體產生,c極無變化 d極溶解,c極有氣體產生 電流從a極流向d極 A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c 組卷:240引用:33難度:0.7 -
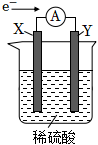 5.如圖所示的原電池裝置,X、Y為兩電極,電解質溶液為稀硫酸,外電路中的電子流向如圖所示,對此裝置的下列說法正確的是( )
5.如圖所示的原電池裝置,X、Y為兩電極,電解質溶液為稀硫酸,外電路中的電子流向如圖所示,對此裝置的下列說法正確的是( )A.外電路的電流方向為:X→外電路→Y B.若兩電極分別為Zn和石墨棒,則X為石墨棒,Y為Zn C.SO42-移向X電極,Y電極上有氫氣產生 D.X極上發生的是還原反應,Y極上發生的是氧化反應 組卷:222引用:15難度:0.9 -
6.a、b兩個燒杯中均盛有100mL等濃度的稀H2SO4,將足量的兩份鋅粉分別加入兩個燒杯中,同時向a中加入少量CuSO4溶液,下列產生氫氣的體積(V)與時間(t)的關系正確的是( )
A. 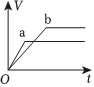
B. 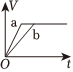
C. 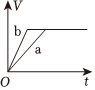
D. 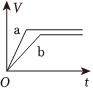 組卷:110引用:6難度:0.7
組卷:110引用:6難度:0.7 -
7.在2L的密閉容器中,發生反應:2A(g)+B(g)?2C(g)+D(g)。若最初加入的A和B都是4mol,在前10秒A的平均反應速率為0.12mol/(L?S),則10秒時,容器中B的物質的量是( )
A.1.6mol B.2.8mol C.2.4mol D.1.2mol 組卷:284引用:8難度:0.8
二、非選擇題(共5小題,共52分)
-
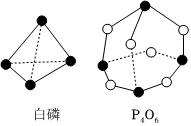 20.化學反應過程可視為舊鍵斷裂和新鍵形成的過程。化學鍵的鍵能是形成(或拆開)1mol化學鍵時釋放(或吸收)的能量。已知白磷和P4O6的分子結構如圖所示,現提供以下化學鍵的鍵能:P-P為198kJ?mol-1、P-O為360kJ?mol-1、O=O為498kJ?mol-1。則P4(白磷)+3O2═P4O6的反應是 (填“吸熱”或“放熱”)反應,生成1molP4O6(填“吸收”或“放出”)的熱量為。組卷:152引用:2難度:0.7
20.化學反應過程可視為舊鍵斷裂和新鍵形成的過程。化學鍵的鍵能是形成(或拆開)1mol化學鍵時釋放(或吸收)的能量。已知白磷和P4O6的分子結構如圖所示,現提供以下化學鍵的鍵能:P-P為198kJ?mol-1、P-O為360kJ?mol-1、O=O為498kJ?mol-1。則P4(白磷)+3O2═P4O6的反應是 (填“吸熱”或“放熱”)反應,生成1molP4O6(填“吸收”或“放出”)的熱量為。組卷:152引用:2難度:0.7 -
21.將濃度均為0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定時間后溶液變為藍色。該實驗是一種“碘鐘實驗”。某小組同學在室溫下對該“碘鐘實驗”的原理進行探究。
【資料】
該“碘鐘實驗”的總反應:H2O2 +2S2O32-+2H+═S4O62-+2H2O
反應分兩步進行:
反應A:H2O2 +2I-+2H+═I2+2H2O
反應B:……
(1)反應B的離子方程式是。對于總反應,I-的作用相當于。
(2)為證明反應A、B的存在,進行實驗Ⅰ。
a.向酸化的H2O2溶液中加入試劑X的水溶液,溶液變為藍色。
b.再向得到的藍色溶液中加入Na2S2O3溶液,溶液的藍色褪去。
試劑X是。
試劑
(3)為探究溶液變藍快慢的影響因素,進行實驗Ⅱ、實驗Ⅲ。
(溶液濃度均為0.01 mol/L)
溶液從混合時的無色變為藍色的時間:實驗Ⅱ是30 min、實驗Ⅲ是40 min。用量(ML)
序號H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液
(含淀粉)
H2O實驗Ⅱ 5 4 8 3 0 實驗Ⅲ 5 2 x y z
①實驗Ⅲ中,x、y、z所對應的數值分別是。
②對比實驗Ⅱ、實驗Ⅲ,可得出的實驗結論是。
(4)為探究其他因素對該“碘鐘實驗”的影響,進行實驗Ⅳ.(溶液濃度均為0.01 mol/L)
實驗過程中,溶液始終無明顯顏色變化。用量(mL)
號
試劑H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液(含淀粉)
H2O實驗Ⅳ 4 4 9 3 0
試結合該“碘鐘實驗”總反應方程式及反應A與反應B速率的相對快慢關系,解釋實驗Ⅳ未產生顏色變化的原因:。組卷:135引用:17難度:0.5


