2016-2017學年湖北省荊州市沙市中學高二(下)第一次雙周考化學試卷(A卷)
發布:2024/4/20 14:35:0
一、選擇題(共20小題,每小題2分,滿分40分)
-
1.以下表示氦原子結構的化學用語中,對電子運動狀態描述最詳盡的是( )
A.He B. 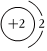
C.1s2 D. 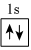 組卷:184引用:20難度:0.9
組卷:184引用:20難度:0.9 -
2.下列分子中,中心原子的雜化類型相同,分子空間構型也相同的是( )
A.H2O、SO2 B.BeCl2、CO2 C.H2O、NH3 D.NH3、CH2O 組卷:24引用:2難度:0.9 -
3.有關化學反應的說法中,正確的是( )
A.非自發反應在任何條件下都不能實現 B.自發反應都是熵增大的反應 C.能自發進行的吸熱反應一定是熵增大的反應 D.自發反應都是放熱反應 組卷:44引用:3難度:0.9 -
4.有關碰撞理論,下列說法中正確的是( )
A.具有足夠能量的分子(活化分子)相互碰撞就一定能發生化學反應 B.增大反應物濃度,可增大活化分子的百分數,從而使有效碰撞次數增大 C.升溫能使化學反應速率增大,主要原因是增加了反應物分子中活化分子的百分數 D.催化劑不影響反應活化能,從而只影響反應速率不影響化學平衡 組卷:112引用:26難度:0.7 -
5.下列關于鍵長、鍵能和鍵角的說法中不正確的是( )
A.鍵角是描述分子立體結構的重要參數 B.鍵長的大小與成鍵原子的半徑和成鍵數目有關 C.C=C鍵的鍵能等于C—C鍵鍵能的2倍 D.因為O—H鍵的鍵能小于H—F鍵的鍵能,所以O2、F2與H2反應的能力逐漸增強 組卷:76引用:3難度:0.7 -
6.下面的問題中,與鹽類水解有關的是( )
①為保存FeCl2溶液,要在溶液中加入少量鹽酸;
②實驗室盛放Na2CO3、Na2SiO3等溶液的試劑瓶應用橡膠塞;
③在NH4Cl或AlCl3溶液中加入鎂條會產生氣泡;
④長期使用硫酸銨,土壤酸性增強.A.只有①④ B.只有②③ C.只有③④ D.全部 組卷:47引用:4難度:0.7 -
7.現有四種元素的基態原子的電子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.則下列有關比較中正確的是( )
A.最高正化合價:③>②>① B.第一電離能:③>②>① C.電負性:③>②>① D.原子半徑:③>②>① 組卷:268引用:105難度:0.5 -
8.下列各組原子中,彼此化學性質一定相似的是( )
A.原子核外電子排布式為1s2的X原子與原子核外電子排布式為1s22s2的Y原子 B.原子核外M層上僅有兩個電子的X原子與原子核外N層上僅有兩個電子的Y原子 C.2p軌道上有一個空軌道的X原子與3p軌道上有一個空軌道的Y原子 D.最外層都只有一個電子的X、Y原子 組卷:20引用:9難度:0.7
二、解答題(共6小題,滿分60分)
-
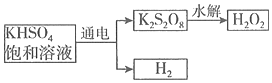 25.雙氧水最主要的用途是漂白劑和殺菌消毒,在環境保護、化學合成和工業生產中有著廣泛的用途。查閱資料得知:工業上用電解KHSO4飽和溶液制取H2O2,示意圖如圖:
25.雙氧水最主要的用途是漂白劑和殺菌消毒,在環境保護、化學合成和工業生產中有著廣泛的用途。查閱資料得知:工業上用電解KHSO4飽和溶液制取H2O2,示意圖如圖:
(1)電解KHSO4飽和溶液陽極的電極反應式為,K2S2O8水解時
生成H2O2和KHSO4,寫出該反應的化學方程式。
(2)已知
①2H2O2(l)═2H2O(l)+O2(g)△H1=-196.46kJ/mol;
②H2(g)+O2(g)═H2O(l)△H2=-285.84kJ/mol;12
③H2(g)+Cl2(g)═2HCl(g)△H3=-184.6kJ/mol。
用H2O2(l)可除去工業尾氣中的Cl2(g),生成HCl(g)和O2(g),該反應的熱化學方程式為。
(3)在堿性介質中,H2O2有較強的還原性,可與Ag2O反應,該反應的氧化劑和還原劑的物質的量之比為。
(4)某實驗小組同學用此法制取一定濃度的H2O2溶液,并進行下列實驗以測定H2O2的質量分數:
Ⅰ.將5.00mL H2O2溶液(密度為1g/mL)置于錐形瓶中加水稀釋,再加稀硫酸酸化;
Ⅱ.用0.1000mol/L的KMnO4溶液滴定;
Ⅲ.用同樣方法滴定,三次消耗KMnO4溶液的體積分別為20.00mL、19.98mL、20.01mL。
①操作Ⅱ中,滴入第一滴KMnO4溶液,溶液的紫紅色消失很慢,隨滴定過程中Mn2+的增多,溶液的紫紅色消失速率加快。Mn2+的作用是。
②原H2O2溶液中溶質的質量分數為。組卷:1引用:1難度:0.5 -
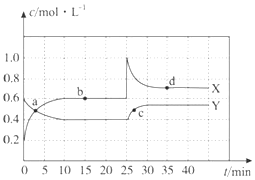 26.在一定條件下,NO2和N2O4可以互相轉化:2NO2(g)?N2O4(g)△H<0.現將一定量的NO2和N2O4混合氣體通入體積為2L的恒溫密閉玻璃容器中,反應物濃度隨時間變化關系如圖所示。
26.在一定條件下,NO2和N2O4可以互相轉化:2NO2(g)?N2O4(g)△H<0.現將一定量的NO2和N2O4混合氣體通入體積為2L的恒溫密閉玻璃容器中,反應物濃度隨時間變化關系如圖所示。
(1)圖中共有兩條曲線X和Y,其中曲線表示NO2
濃度隨時間的變化;下列敘述不能說明該反應已達平
衡狀態的是(填序號)。
A.容器內混合氣體的壓強不隨時間變化而改變
B.容器內混合氣體的密度不隨時間變化而改變
C.容器內混合氣體的顏色不隨時間變化而改變
D.容器內混合氣體的平均相對分子質量不隨時間變化而改變
(2)0~15min,反應2NO2(g)?N2O4(g)的平衡常數K(b)=。
(3)反應25min時,若只改變了某一個條件,使曲線發生如圖所示的變化,該條件可能是;其平衡常數K(d)K(b)(填“>、<或=”)。
(4)若要達到使NO2(g)的百分含量與d點相同的化學平衡狀態,在25min時還可以采取的措施是(填序號)。
A.縮小容器體積 B.升高溫度 C.加入一定量的N2O4D.加入催化劑。組卷:2引用:1難度:0.5


