2022-2023學年河南省鄭州市中原名校高二(上)第二次聯考化學試卷
發布:2024/12/11 7:0:2
一、選擇題(共16小題,每題3分,共48分。每小題只有一個選項符合題意。)。
-
1.催化劑是現代化學工業的心臟,下列有關催化劑的說法錯誤的是( )
A.催化劑能加快正逆反應速率并降低能耗 B.催化劑能降低反應所需的活化能 C.催化劑不只是含金屬元素的物質 D.催化劑能改變化學反應的平衡常數 組卷:25引用:1難度:0.9 -
2.受全球低碳節能環保理念、以及我國“雙碳”政策的影響,“地溝油”華麗變身,用于生產生物柴油。下列說法不合理的是( )
A.生物柴油不屬于化石能源 B.“地溝油”經過加工處理可用作生物柴油,實現了廚余垃圾的合理利用 C.生物柴油的燃燒需要點燃,屬于吸熱反應 D.生物柴油在燃燒過程中化學能主要轉化為熱能和光能 組卷:40引用:4難度:0.7 -
3.自發過程:在一定的條件下,不需要外力就可以自動進行的過程。在常溫常壓下,下列詩句反映的景象與自發過程不一致的一項是( )
A.云開霧散旭風暖 B.飛流直下三千尺 C.雪消門外千山綠 D.欲渡黃河冰塞川 組卷:25引用:5難度:0.9 -
4.下列有關合成氨工業的說法正確的是( )
A.恒容條件下充入稀有氣體有利于NH3的合成 B.工業合成氨的反應是熵減小的放熱反應,在低溫或常溫有自發反應的趨勢 C.合成氨廠一般采用的壓強為10MPa~30MPa,因為該壓強下鐵觸媒的活性最高 D.N2的量越多,H2的轉化率越大,因此,充入的N2越多越有利于NH3的合成 組卷:19引用:2難度:0.7 -
5.下列與化學反應能量變化相關的敘述正確的是( )
A.石墨的燃燒熱為393.51kJ?mol-1,金剛石與石墨互為同素異形體,則金剛石的燃燒熱也為393.51kJ?mol-1 B.將1molHCl氣體通入足量0.1mol?L-1NaOH溶液中充分反應,放出的熱量可用于計算中和熱 C.已知C(金剛石,s)=C(石墨,s)ΔH=-1.9kJ/mol,則金剛石的燃燒熱ΔH1小于石墨的燃燒熱ΔH2 D.放熱反應只有在低溫時才能發生,吸熱反應只有在高溫時才能發生 組卷:6引用:1難度:0.6 -
6.已知SO2+4I-+4H+═S↓+2I2+2H2O,現進行如圖所示實驗。下列說法錯誤的是( )
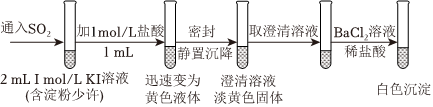
A.改變c(H+)對反應速率沒有影響 B.該反應能夠證明SO2既有氧化性,又有還原性 C.整個反應過程中,KI可能起到了催化劑的作用 D.該過程中SO2發生的總反應可能為3SO2+2H2O═2 +S↓+4H+SO2-4組卷:29引用:2難度:0.8
二、非選擇題(共52分)
-
19.CH4-CO2重整反應:CH4(g)+CO2(g)═2CO(g)+2H2(g),能夠有效去除大氣中的溫室效應氣體,是實現“碳達峰”、“碳中和”的重要途徑之一。
(1)已知:CH4(g)+H2O(g)═CO(g)+3H2(g)ΔH1=+205.9kJ?mol-1CO(g)+H2O(g)═CO2(g)+H2(g)ΔH2=-41.2kJ?mol-1
若重整反應的正反應活化能Ea(正)=840kJ?mol-1,則該反應的逆反應活化能Ea(逆)=kJ?mol-1。
(2)往2L恒容密閉容器中,投入2molCH4和2molCO2,僅發生重整反應。在不同溫度下平衡體系中CH4和CO的物質的量分數φ/%隨溫度變化如圖所示: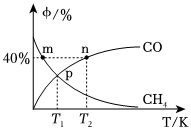
①n點CH4的物質的量分數為。
②m點逆反應速率n點逆反應速率(填“>”、“<”、“=”、“無法確定”),理由是。
③T1溫度下該反應的平衡常數Kc=mol2?L-2。
(3)經研究發現,在實際工業應用中,發生重整反應的同時,還發生了積炭反應:
CO歧化:2CO(g)═CO2(g)+C(s)ΔH=-172kJ?mol-1CH4裂解:CH4(g)═C(s)+2H2(g)ΔH=+75kJ?mol-1
積炭的存在會使催化劑失活。積炭反應中,溫度和壓強與平衡炭量的關系如圖。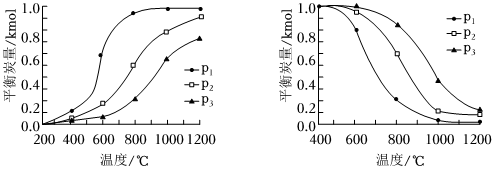
圖a圖b
①其中表示溫度和壓強對CH4裂解反應中平衡炭量影響的是圖(填“a”或“b”),理由是。
②圖中壓強p1、p2、p3的大小關系是。
③實驗表明,在重整反應過程中積炭主要由CO歧化反應產生。則實際工業應用中,應采用條件為宜。
A.高溫高壓
B.高溫低壓
C.低溫高壓組卷:27引用:2難度:0.4 -
20.如圖是某實驗小組故進的中和反應反應熱測定實驗裝置。組裝儀器后,先在塑料瓶中加入50mL0.50mol?L-1鹽酸,然后通過注射器注入50mL0.55mol?L-1NaOH溶液、通過測定反應過程中所放出的熱量可計算反應熱。回答下列問題:
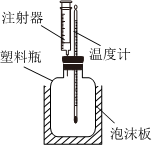
(1)塑料瓶外泡沫板的作用是,缺少的儀器是。
(2)假設鹽酸和氫氧化鈉溶液的密度都是1g?cm-3,又知中和反應后生成溶液的比熱容c=4.18J?g-1?C-1,為了計算中和熱,某學生實驗記錄數據如下:
依據該學生的實驗數據計算,該實驗測得的中和熱ΔH=實驗序號 起始溫度T1/℃ 終止溫度T2/℃ 鹽酸 氫氧化鈉溶液 混合溶液 1 20.0 20.2 23.2 2 20.2 20.4 23.4 3 20.3 20.5 25.6 (結果保留一位小數)。
(3)有同學考慮注射器針筒中會有NaOH溶液殘留(不超過0.5mL),認為上述實驗會導致所測得反應熱偏小,請判斷該觀點是否正確并說明理由:。
(4)如果用60mL0.50mol?L-1鹽酸與60mL0.55mol?L-1NaOH溶液進行反應,與上述實驗相比,所放出的熱量(填“相等”或“不相等”,下同)、所求中和熱。
(5)現將一定量的稀氫氧化鈉溶液、稀氫氧化鈣溶液、稀氨水分別和1L1mol?L-1的稀鹽酸恰好完全反應,其反應熱分別為ΔH1、ΔH2、ΔH3,則ΔH1、ΔH2、ΔH3的大小關系為。組卷:7引用:1難度:0.7


