人教版(2019)選擇性必修1《3.1 電離平衡》2020年同步練習卷(6)
發布:2024/4/20 14:35:0
-
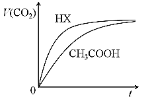 1.25℃時,將20mL 0.10 mol/LCH3COOH溶液和20mL 0.10 mol/LHX溶液分別與20mL 0.10 mol/LNaHCO3溶液混合,測得產生氣體的體積(V)隨時間(t)變化如下圖,下列說法中不正確的是( )
1.25℃時,將20mL 0.10 mol/LCH3COOH溶液和20mL 0.10 mol/LHX溶液分別與20mL 0.10 mol/LNaHCO3溶液混合,測得產生氣體的體積(V)隨時間(t)變化如下圖,下列說法中不正確的是( )A.反應開始前,HX溶液中c(H+)大于CH3COOH中c(H+) B.CH3COOH溶液反應結束后,c(Na+)>c(CH3COO-) C.反應結束后所得兩溶液中,c(CH3COO-)<c(X-) D.由該實驗可知HX為強酸 組卷:116引用:2難度:0.5 -
2.從植物花朵中提取到一種色素,它實際上是一種有機弱酸,可用HR表示,HR在鹽酸溶液中呈現紅色,HR在NaOH溶液中呈現藍色,將HR加入濃硝酸中呈現紅色,微熱后溶液的紅色褪去,根據以上現象,可推測( )
A.HR應為紅色 B.HR應為藍色 C.R-應為無色 D.R-應為紅色 組卷:155引用:10難度:0.7 -
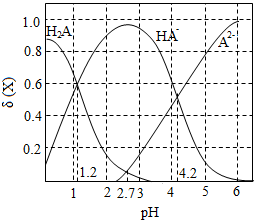 3.改變0.1mol?L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物質的量分數隨pH的變化如圖所示。下列敘述錯誤的是( )
3.改變0.1mol?L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物質的量分數隨pH的變化如圖所示。下列敘述錯誤的是( )A.pH=1.2時,c(H2A)=c(HA-) B.lg[K2(H2A)]=-4.2 C.pH=2.7時,c(HA-)>c(H2A)=c(A2-) D.pH=4.2時,c(HA-)=c(H2A)=c(A2-) 組卷:133引用:4難度:0.5 -
4.現有室溫下四種溶液,有關敘述不正確的是( )
編號 ① ② ③ ④ pH 10 10 4 4 溶液 氨水 氫氧化鈉溶液 醋酸溶液 鹽酸 A.相同體積③、④溶液分別與NaOH完全反應,消耗NaOH物質的量:③>④ B.VaL④溶液與VbL②溶液混合(近似認為混合溶液體積=Va+Vb),若混合后溶液pH=5,則Va:Vb=9:11 C.①、④兩溶液等體積混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) D.分別加水稀釋10倍,四種溶液的pH:①>②>④>③ 組卷:79引用:3難度:0.9 -
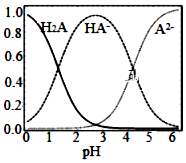 5.25℃時,在“H2A?HA--A2-”的水溶液體系中,H2A、HA-和A2-三者中各自所占的物質的量分數(α)隨溶液pH變化的關系如圖所示.下列說法不正確的是( )
5.25℃時,在“H2A?HA--A2-”的水溶液體系中,H2A、HA-和A2-三者中各自所占的物質的量分數(α)隨溶液pH變化的關系如圖所示.下列說法不正確的是( )A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固體,α(HA-)可能增大 B.將等物質的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-) C.NaHA溶液中,HA-的水解能力小于HA-的電離能力 D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),則α(H2A)≤α(HA-) 組卷:16引用:1難度:0.4 -
6.室溫下,向10mL 0.1mol/L醋酸溶液中加水稀釋后,下列說法正確的是( )
A.溶液中導電粒子的數目減小 B.溶液中 增大c(CH3COO-)c(CH3COOH)C.再加入CH3COONa固體能促進醋酸的電離 D.醋酸的電離程度增大,c(H+)增大,且醋酸的電離常數K隨其物質的量濃度減小而減小 組卷:67引用:3難度:0.5 -
7.能證明Na2SO3溶液中存在水解平衡SO32-+H2O?HSO3-+OH-的事實是( )
A.滴入酚酞試液變紅,再加入H2SO4溶液后紅色褪去 B.滴入酚酞試液變紅,再加入新制氯水后紅色褪去 C.滴入酚酞試液變紅,再加入BaCl2溶液后產生沉淀且紅色褪去 D.滴入酚酞試液變紅,再加入氫氧化鈉后溶液紅色加深 組卷:33引用:1難度:0.7
-
22.電解質的水溶液中存在電離平衡。
Ⅰ.(1)醋酸是常見的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH電離程度增大的是(填字母序號)。
a.滴加少量濃鹽酸 b.微熱溶液 c.加水稀釋 d.加入少量醋酸鈉晶體
Ⅱ.白醋是常見的烹調酸味輔料,白醋總酸度測定方法如下。
a.量取20.00 mL白醋樣品,用100 mL容量瓶配制成待測液。
b.將滴定管洗凈、潤洗,裝入溶液,趕出尖嘴處氣泡,調整液面至0刻度線。
c.取20.00 mL配制的待測液于潔凈的錐形瓶中,加3滴酚酞溶液,用0.1000 mol?L-1的NaOH溶液滴定至終點,記錄數據。
d.重復滴定實驗3次并記錄數據。
e.計算白醋樣品中醋酸總酸度。回答下列問題:
(2)實驗a中量取20.00 mL白醋所用的儀器名稱是。
(3)若實驗b中堿式滴定管未用NaOH標準溶液潤洗,會造成測定結果比準確值(填“偏大”、“偏小”或“不變”)。
(4)實驗C中判斷滴定終點的現象是。
(5)實驗數據如下表,則該白醋樣品中醋酸總酸度為mol?L-1。
Ⅲ.25℃,向20.00 mL 0.100 0 mol?L-1 CH3COOH中滴加0.100 0 mol?L-1 NaOH過程中,pH變化如圖所示。待測液體積/mL 標準NaOH溶液 滴定前讀數/mL 滴定終點讀數/mL 第1次 20.00 0 21.98 第2次 20.00 0 22.00 第3次 20.00 0 22.02 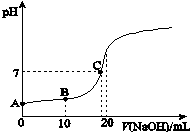
(6)A點溶液pH>1,用電離方程式解釋原因:。
(7)下列有關B點溶液的說法正確的是(填字母序號)。
a.溶質為:CH3COOH、CH3COONa
b.微粒濃度滿足:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c.微粒濃度滿足:c(Na+)=c(CH3COOH)+c(CH3COO-)
d.微粒濃度滿足:2c(H+)+c(CH3COO-)=2c(OH-)+c(CH3COOH)
(8)C點溶液中離子濃度的大小順序:。組卷:29引用:2難度:0.7 -
23.通常用Ka表示弱酸的電離平衡常數,請回答下列問題:
(1)已知亞磷酸(H3PO3)為二元弱酸,常溫下Kal=1.6×10-2,Ka2=7×10-7。
①Na2HPO3屬于。(填“正鹽”或“酸式鹽”)
②已知常溫下Ka(CH5COOH)=1.8×10-5,寫出亞磷酸溶液與醋酸鈉溶液反應的離子方程式:。
③常溫下向10mL 0.01mol?L-1H3PO3溶液中滴加10mL 0.03mol?L-1NaOH溶液,發生反應的離子方程式為。
(2)常溫下,取0.3mol?L-1HY溶液與0.3mol?L-1NaOH溶液等體積混合(不計混合后溶液體積變化),測得混合溶液的pH=9。
①該混合溶液中由水電離出來的c(OH-)=。
②常溫下HY的電離平衡常數Ka=。
③c(OH-)-c(HY)=mol?L-1。組卷:19引用:1難度:0.4


