2021-2022學(xué)年云南省玉溪師范學(xué)院附中高二(上)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(共20小題,每小題3.0分,共60分)
-
1.右表為元素周期表前四周期的一部分,下列有關(guān)R、W、X、Y、Z五種元素的敘述中,正確的是( )

A.常壓下五種元素的單質(zhì)中,Z單質(zhì)的沸點最高 B.Y元素的非金屬性比W元素的非金屬性強 C.W的氫化物的沸點比X的氫化物的沸點高 D.Y、Z的陰離子電子層結(jié)構(gòu)都與R原子的相同 組卷:7引用:2難度:0.6 -
2.關(guān)于電解NaCl水溶液,下列敘述正確的是( )
A.電解時在陽極得到氯氣,在陰極得到金屬鈉 B.若在陽極附近的溶液中滴入KI溶液,溶液呈棕色 C.若在陰極附近的溶液中滴入酚酞試液,溶液呈無色 D.電解一段時間后,將全部電解液轉(zhuǎn)移到燒杯中,充分?jǐn)嚢韬笕芤撼手行?/label> 組卷:212引用:56難度:0.7 -
3.某蓄電池放電、充電的反應(yīng)式為:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2,下列推斷中正確的是( )放電充電
①放電時,F(xiàn)e為正極,Ni2O3為負(fù)極;
②充電時,陰極上的電極反應(yīng)式是:Fe(OH)2+2e-═Fe+2OH-;
③充電時,Ni(OH)2為陽極;
④蓄電池的電極必須浸在某堿性溶液中。A.①②③ B.①②④ C.①③④ D.②③④ 組卷:14引用:14難度:0.7 -
4.對已經(jīng)達(dá)到化學(xué)平衡的下列反應(yīng):2X(g)+Y(g)?2Z(g)△H<0,降低溫度時,對反應(yīng)產(chǎn)生的影響是.( )
A.逆反應(yīng)速率增大,正反應(yīng)速率減小,平衡向逆反應(yīng)方向移動 B.逆反應(yīng)速率減小,正反應(yīng)速率增大,平衡向正反應(yīng)方向移動 C.正、逆反應(yīng)速率都減小,平衡向逆反應(yīng)方向移動 D.正、逆反應(yīng)速率都減小,平衡向正反應(yīng)方向移動 組卷:50引用:9難度:0.9 -
5.溴單質(zhì)在四氯化碳中的溶解度比在水中大,這是因為( )
A.溴單質(zhì)和四氯化碳中都含有鹵素原子 B.Br2是單質(zhì),CCl4是化合物 C.Br2是非極性分子,CCl4也是非極性分子,而水是極性分子 D.Br2、CCl4都是有機(jī)物,而H2O是無機(jī)物 組卷:51引用:2難度:0.8 -
6.下列中心原子的雜化軌道類型和分子幾何構(gòu)型均不正確的是( )
A.CCl4中C原子sp3雜化,為正四面體形 B.BF3中B原子sp2雜化,為平面三角形 C.CS2中C原子sp雜化,為直線形 D.H2S分子中,S為sp雜化,為直線形 組卷:237引用:11難度:0.7 -
 7.常溫下,15ml某待測物質(zhì)的量濃度的鹽酸,用一定物質(zhì)的量濃度的NaOH溶液滴定的滴定曲線如圖所示,則兩種溶液的物質(zhì)量的濃度分別是( )
7.常溫下,15ml某待測物質(zhì)的量濃度的鹽酸,用一定物質(zhì)的量濃度的NaOH溶液滴定的滴定曲線如圖所示,則兩種溶液的物質(zhì)量的濃度分別是( )A B C D c(HCl)(mol/L) 0.12 0.06 0.05 0.1 c(NaOH)(mol/L) 0.06 0.12 0.1 0.05 A.A B.B C.C D.D 組卷:13引用:2難度:0.5 -
8.下列說法正確的是( )
A.水的電離方程式:H2O═H++OH- B.在水中加入氯化鈉,對水的電離沒有影響 C.在NaOH溶液中沒有H+ D.在HCl溶液中沒有OH- 組卷:8引用:1難度:0.7
二、非選擇題(共4小題,共40分)
-
23.A、B、C、D、E為元素周期表中前20號元素,其原子序數(shù)依次增大。其中C、E是金屬元素;A和E同主族,它們原子的最外層電子排布式均為ns1;B和D同主族,它們原子最外層的p能級電子數(shù)是s能級電子數(shù)的2倍;C元素原子最外層電子數(shù)是D元素原子最外層電子數(shù)的
。已知五種元素的電負(fù)性為2.5、3.5、0.8、2.1、1.5,請回答下列問題:12
(1)A是(填元素符號,下同),B是,C是,D是,E是。
(2)五種元素中金屬性最強的是(填元素符號,下同),非金屬性最強的是。
(3)當(dāng)B與A、C、D分別形成化合物時,B顯(填“正”或“負(fù)”,下同)價,其他元素顯價。
(4)當(dāng)B與A、C、D、E分別形成簡單化合物(其中A、C、D、E均顯最高價,B顯最低負(fù)價)時,化合物中含有離子鍵的是(填化學(xué)式,下同),含有共價鍵的是。組卷:1引用:3難度:0.7 -
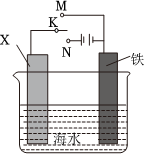 24.鋼鐵在自然界中的腐蝕比較普遍。
24.鋼鐵在自然界中的腐蝕比較普遍。
(1)遠(yuǎn)洋輪船的鋼鐵船體在海水中易發(fā)生電化學(xué)腐蝕中的腐蝕。為防止這種腐蝕,通常把船體與浸在海水里的Zn塊相連,或與像鉛酸蓄電池這樣的直流電源的(填“正”或“負(fù)”)極相連。
(2)若用鋼鐵(含F(xiàn)e、C)制品盛裝NaClO溶液會發(fā)生電化學(xué)腐蝕,鋼鐵制品表面生成紅褐色沉淀,溶液會失去漂白、殺菌消毒功效。該電化腐蝕過程中的正極反應(yīng)式為。
(3)鐵器深埋地下,也會發(fā)生嚴(yán)重的電化學(xué)腐蝕,原因是一種稱為硫酸鹽還原菌的細(xì)菌,能提供正極反應(yīng)的催化劑,將土壤中的還原為S2-,試寫出該電化學(xué)腐蝕的正極反應(yīng)式SO2-4。
(4)利用圖中裝置,可以模擬鐵的電化學(xué)防護(hù)。若X為碳棒,為減緩鐵的腐蝕,開關(guān)K應(yīng)置于處。若X為鋅,開關(guān)K置于M處,該電化學(xué)防護(hù)法稱為。組卷:7引用:1難度:0.7


