2021-2022學年江蘇省揚州市高三(上)期末化學試卷
發布:2024/12/17 15:30:2
一、單項選擇題:本題包括14小題,每小題3分,共計42分。每小題只有一個選項符合題意。
-
1.Na2ZnO2可用于鑒別天絲和銅氨纖維。以ZnCO3為原料制備Na2ZnO2涉及的反應有ZnCO3
ZnO+CO2↑;ZnO+2NaOH═Na2ZnO2+H2O。下列說法正確的是( )△A.CO2屬于非極性分子 B.ZnO屬于堿性氧化物 C.ZnO和NaOH的反應屬于氧化還原反應 D.Na2ZnO2在水溶液中電離出Na+、Zn2+、O2- 組卷:19引用:1難度:0.7 -
2.K3[Cu(CN)4]可用于電鍍。Cu與KCN溶液反應的方程式為2Cu+8KCN+2H2O═2K3[Cu(CN)4]+2KOH+H2↑。下列說法正確的是( )
A.中子數為35的銅原子: 
B.K+的結構示意圖: 
C.K3[Cu(CN)4]中存在極性鍵和非極性鍵 D.CN-的電子式為  組卷:83引用:2難度:0.6
組卷:83引用:2難度:0.6 -
3.下列有關物質的性質與用選具有對應關系的是( )
A.NH3易溶于水,可用作制冷劑 B.NH4HCO3受熱易分解,可用作氮肥 C.N2的化學性質穩定,可用作食品保護氣 D.N2H4(肼)具有氧化性,可用作高能燃料 組卷:29引用:2難度:0.6 -
4.實驗室制備NaClO消毒液,有關實驗裝置和原理不能達到實驗目的的是( )
A. 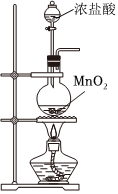 制備Cl2
制備Cl2B. 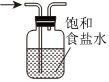 除去Cl2中混有的少量HCl
除去Cl2中混有的少量HClC. 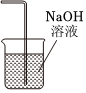 吸收Cl2
吸收Cl2D. 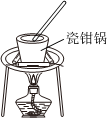 蒸發濃縮NaClO消毒液組卷:18引用:2難度:0.5
蒸發濃縮NaClO消毒液組卷:18引用:2難度:0.5 -
5.短周期主族元素X、Y、Z、W的原子序數依次增大,X與Y位于同一主族,X元素原子的最外層電子數為次外層電子數的兩倍,Z元素基態原子的最外層有3個未成對電子,W的單質常溫下為氣體。下列有關說法正確的是( )
A.第一電離能:I1(Z)>I1(Y) B.原子半徑:r(W)>r(Y)>r(X) C.元素Y的簡單氣態氫化物的熱穩定性比X的強 D.元素X最高價氧化物的水化物的酸性比W的強 組卷:25引用:1難度:0.6
二、非選擇題(共58分)
-
17.水楊醛亞胺的鈷配合物可吸收O2形成氧載體,用于燃料油的氧化脫硫。
(1)制備鈷配合物
向燒瓶中加入水楊醛亞胺(A)、無水乙醇,水浴加熱條件下迅速加入醋酸鈷溶液。生成的沉淀冷卻至寶溫后,抽濾,重結晶,干燥,得到水楊醛亞胺的鈷配合物(B)。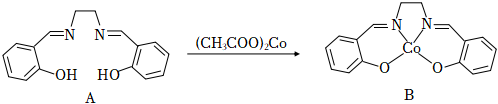
①基態Co2+核外電子排布式為。配合物B中的配位原子是。
②可供選擇的實驗裝置如圖所示,應選(填序號)用于制備,理由有。
③為避免反應過程中生成的鈷配合物(B)吸收O2,可采用的方法為。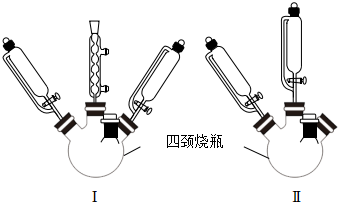
(2)制備醋酸鈷溶液
利用廢鈷鎳電池的金屬電極芯(主要成分Co、Ni,還含少量Fe)可生產醋酸鈷溶液。已知:Co3+可將H2O2氧化;Ni3+氧化性i強,在水溶液中不存在;在實驗條件下,部分陽離子沉淀時溶液pH如表。
①酸性溶液中加入NaClO可將Co2+氧化Co(OH)3,其離子方程式為沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Co(OH)3 Ni(OH)2 開始沉淀 2.2 7.4 7.6 0.1 7.6 完全沉淀 3.2 8.9 9.2 1.1 9.2 。
②請補充完整實驗方案:取一定量已粉碎的電極芯,加入稀H2SO4充分溶解后過濾,所得濾液中含Co2+、Ni2+、Fe2+,,加入10%Na2CO3溶液生成CoCO3沉淀,用CH3COOH溶解得到醋酸鈷溶液(實驗中須使用的試劑:NaClO溶液、稀H2SO4、H2O2溶液、NaOH溶液)。組卷:16引用:2難度:0.4 -
18.CH4-CO2重整能獲得氫能,同時能高效轉化溫室氣體。
(1)CH4-CO2重整反應的熱化學方程式為
反應Ⅰ:CH4(g)+CO2(g)═2CO(g)+2H2(g)ΔH1
反應Ⅱ:H2(g)+CO2(g)═CO(g)+H2O(g)ΔH2=41kJ?mol-1
反應Ⅲ:CH4(g)═C(s)+2H2(g)ΔH2=75kJ?mol-1
1.01×105Pa下,將n起始(CO2):n起始(CH4)=1:1的混合氣體置于密閉容器中,不同溫度下重整體系中,平衡時各組分的物質的量分數如圖1所示。
①CH4-CO2重整的主反應為(填“反應Ⅰ”、“反應Ⅱ”或“反應Ⅲ”),判斷的理由是。
②450~750℃時,平衡體系中CH4物質的量分數比CO2略大的原因是。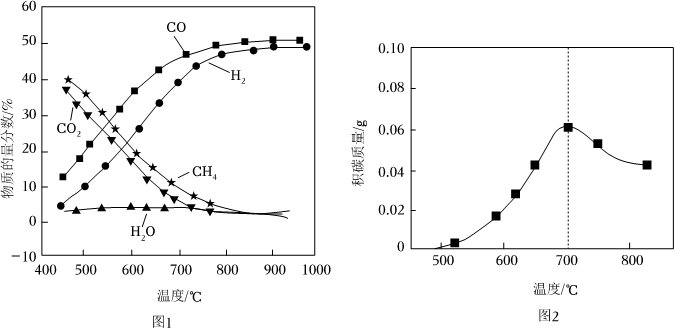
(2)CH4-CO2重整過程中的積碳是反應催化劑失活的主要原因。積碳反應除反應Ⅲ外,還發生反應Ⅳ:2CO(g)═C(s)+CO2(g)ΔH4=-172kJ?mol-1積碳反應能迅速到達平衡狀態。CH4-CO2重整反應中1g催化劑上產生的積碳的質量與溫度的關系如圖2所示。
①ΔH=kJ?mol-1。
②溫度低于700℃時,積碳的質量隨溫度的升高而增多的原因是。
(3)在催化劑a和催化劑b分別作用下,CH4-CO2重整反應相同時間,控制其他條件相同,催化劑表面均產生積碳。對附著積碳的催化劑a和催化劑b在空氣中加熱以除去積碳(該過程催化劑不發生反應),固體的質量變化如圖3所示。則重整反應中能保持較長時間催化活性的是(填“催化劑a”或“催化劑b”),判斷的理由是。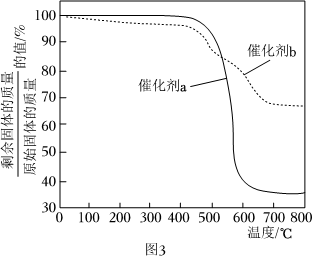 組卷:36引用:1難度:0.6
組卷:36引用:1難度:0.6


