2020年天津市南開區高考化學二模試卷
發布:2025/1/3 7:0:2
一、選擇題
-
1.化學在人類社會發展中發揮著重要作用,下列事實涉及化學反應的是( )
A.氕、氘用作“人造太陽”核聚變燃料 B.燒結黏土制陶瓷 C.打磨磁石制指南針 D.利用蒸餾法從海水中分離出淡水 組卷:84引用:2難度:0.7 -
2.下列化學用語表示正確的是( )
A.CO2的結構式:O-C-O B.N2的電子式: 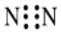
C.H2O的VSEPR模型名稱:四面體 D.乙烯的實驗式:C2H4 組卷:61引用:2難度:0.7 -
3.下列說法正確的是( )
A.黃銅是銅的合金,屬于混合物 B.二氧化氮能溶于水生成硝酸,屬于酸性氧化物 C.氧化鋁可用于制作高溫結構陶瓷制品,屬于金屬材料 D.生物柴油可作內燃機的燃料,屬于烴類 組卷:154引用:1難度:0.7 -
4.醫用外科口罩中過濾層所用材料是熔噴聚丙烯,具有阻隔部分病毒和細菌的作用,口罩生產中還需使用環氧乙烷進行滅菌。下列說法正確的是( )
A.熔噴聚丙烯的鏈節為CH2=CHCH3 B.熔噴聚丙烯可以使溴的四氯化碳溶液褪色 C.廢棄的醫用外科口罩屬于可回收垃圾 D.2CH2=CH2+O2 Agh→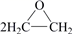 是一種最理想的“原子經濟性反應”組卷:66引用:1難度:0.7
是一種最理想的“原子經濟性反應”組卷:66引用:1難度:0.7 -
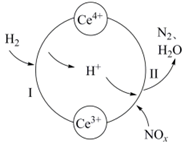 5.硝酸廠的煙氣中含有大量的氮氧化物(NOx),將煙氣與H2的混合氣體通入Ce(SO4)2與Ce2(SO4)3[Ce中文名“鈰”]的混合溶液中實現無害化處理,其轉化過程如圖所示。下列說法正確的是( )
5.硝酸廠的煙氣中含有大量的氮氧化物(NOx),將煙氣與H2的混合氣體通入Ce(SO4)2與Ce2(SO4)3[Ce中文名“鈰”]的混合溶液中實現無害化處理,其轉化過程如圖所示。下列說法正確的是( )A.該轉化過程的實質為NOx被H2還原 B.x=1時,過程Ⅱ中氧化劑與還原劑的物質的量之比為2:1 C.處理過程中,混合溶液中Ce3+和Ce4+總數減少 D.過程Ⅰ發生反應的離子方程式:H2+Ce4+═2H++Ce3+ 組卷:286引用:5難度:0.5
二、非選擇題
-
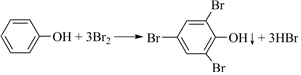 15.工業上處理含苯酚廢水的過程如下。回答下列問題:
15.工業上處理含苯酚廢水的過程如下。回答下列問題:
Ⅰ.測定廢水中苯酚的含量。
測定原理如圖:
測定步驟:
步驟1:準確量取25.00mL待測廢水于250mL錐形瓶中。
步驟2:將5.00mLamol/L濃溴水(過量)迅速加入到錐形瓶中,塞緊瓶塞,振蕩。
步驟3:打開瓶塞,向錐形瓶中迅速加入bmL0.10mol/LKI溶液(過量),塞緊瓶塞,振蕩。
步驟4:以淀粉作指示劑,用0.010mol/L Na2S2O3標準溶液滴定至終點,消耗Na2S2O3標準溶液V1mL.(反應原理:I2+2Na2S2O3═2NaI+Na2S4O6)。
把待測廢水換為蒸餾水,重復上述各步驟(即進行空白實驗),消耗Na2S2O3標準溶液V2mL(以上數據均已扣除干擾因素)。
(1)步驟1中量取待測廢水所用儀器是。
(2)步驟2中塞緊瓶塞的原因是。
(3)步驟4中滴定終點的現象為。
(4)該廢水中苯酚的含量為mg/L(用含V1、V2的代數式表示)。
(5)如果“步驟4”滴定至終點時仰視讀數,則測得消耗Na2S2O3標準溶液的體積V1mL(填“偏大”、“偏小”或“無影響”,下同);如果空白實驗中的“步驟2”忘記塞緊瓶塞,則測得的廢水中苯酚的含量。
Ⅱ.處理廢水。
采用Ti基PbO2為陽極,不銹鋼為陰極,含苯酚的廢水為電解液,通過電解,陽極上產生羥基(?OH),陰極上產生H2O2.通過交替排列的陰陽兩極的協同作用,在各自區域將苯酚深度氧化為CO2和H2O。
(6)寫出陽極的電極反應式。
(7)寫出苯酚在陰極附近被H2O2深度氧化的化學方程式。組卷:76引用:1難度:0.5 -
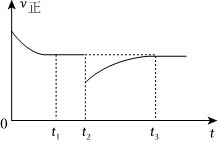 16.工業煉鐵過程中涉及到的主要反應有:
16.工業煉鐵過程中涉及到的主要反應有:
ⅰ.C(s)+O2(g)═CO2(g)ΔH1=-393kJ/mol
ⅱ.C(s)+CO2(g)═2CO(g)ΔH2=+172kJ/mol
ⅲ.Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)ΔH3
ⅳ.2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)ΔH4=+460kJ/mol
回答下列問題:
(1)反應ⅳ(填“能”或“不能”)在任何溫度下自發進行。
(2)ΔH3=kJ/mol。
(3)T1時,向容積為10L的恒容密閉容器中加入3mol Fe2O3和3mol CO發生反應ⅲ,5min時達到平衡,平衡時測得混合氣體中CO2的體積分數為80%。
①0?5min內反應的平均速率v(CO2)=mol?L-1?min-1。
②該溫度下反應的平衡常數為。
③若將平衡后的混合氣體通入1L 3.6mol/L的NaOH溶液,恰好完全反應,反應的離子方程式為,所得溶液中離子濃度由大到小的順序是。
④下列選項中能夠說明該反應已經達到平衡狀態的是。(填序號)
a.Fe2O3的物質的量不再變化
b.體系的壓強保持不變
c.混合氣體的平均摩爾質量保持不變
d.單位時間內消耗CO和生成CO2的物質的量相等
(4)一定條件下進行反應ⅲ,正向反應速率與時間的關系如圖所示,t2時刻改變了一個外界條件,可能是。組卷:65引用:1難度:0.7


