2022年上海市盧灣高中高考化學模擬試卷(一)(4月份)(線上)
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題2分,共40分,只有一個正確選項,將答案涂在答題卡上)
-
1.2021年,中國航天不斷創(chuàng)造奇跡,“天問一號”著陸火星,“嫦娥五號”采回月壤,“長征六號”送星入軌,“神舟十三號”載人飛天。騰飛中國離不開化學,下列有關說法正確的是( )
A.“嫦娥五號”運載火箭使用液氧、液氫推進劑,產物對環(huán)境無污染 B.“天問一號”所用的太陽能電池帆板,其主要材料是二氧化硅 C.“長征六號”運載火箭箭體采用鋁合金材料,是因為材料強度高、密度大、耐腐蝕 D.“神舟飛船”航天員所使用的操縱桿采用碳纖維材料制作,碳纖維屬于有機高分子材料 組卷:33引用:5難度:0.7 -
2.以下比較中正確的是( )
A.微粒半徑:O2-<F-<Na+ B.金屬性:Li>Na>K>Rb C.分子中的鍵角:CH4>H2O>CO2 D.共價鍵的鍵能:C-C>C-Si>Si-Si 組卷:15引用:1難度:0.8 -
3.NA代表阿伏加德羅常數的值,下列敘述正確的是( )
A.17gH2S與PH3組成的混合氣體中含有的質子數為9NA B.4.6g分子式為C2H6O的有機物中含有C-H鍵數0.5NA C.1mol鐵粉與1mol氯氣充分反應,轉移電子數為3NA D.一定條件下,1molH2與足量碘蒸氣充分反應,生成HI分子數一定小于NA 組卷:19引用:1難度:0.5 -
4.下列說法錯誤的是( )
A.可用新制Cu(OH)2懸濁液檢驗牙膏中甘油的存在 B.可用AgNO3溶液和稀硝酸鑒別NaCl和NaNO3 C.食醋總酸含量測定的滴定實驗中,用甲基橙作指示劑 D.用紙層析法分離Fe3+和Cu2+,將濾紙上的試樣點不能浸入展開劑 組卷:17引用:1難度:0.7 -
5.下列反應過程中,同時有離子鍵、極性共價鍵和非極性共價鍵的斷裂和形成的反應是( )
A.NH4Cl→NH3↑+HCl↑ B.NH3+CO2+H2O→NH4HCO3 C.2NaOH+Cl2→NaCl+NaClO+H2O D.2Na2O2+2CO2→2Na2CO3+O2 組卷:144引用:16難度:0.9 -
6.下列有關物質性質與用途對應關系不正確的是( )
A.NaHCO3能與堿反應,可用作焙制糕點的膨松劑 B.CaO能與SO2反應,可作為工業(yè)廢氣處理時的脫硫劑 C.硅的導電性介于導體和絕緣體之間,可用于制造計算機硅芯片的材料 D.飽和氯水既有酸性又有漂白性,加入適量NaHCO3固體,其漂白性增強 組卷:28引用:4難度:0.6 -
7.對下列粒子組在溶液中能否大量共存的判斷和分析均正確的是( )
粒子組 判斷和分析 A Na+、Al3+、Cl-、NH3?H2O 不能大量共存,因發(fā)生反應:Al3++4NH3?H2O═AlO2-+4NH4++2H2O B H+、K+、S2O32-、SO42- 不能大量共存,因發(fā)生反應:2H++S2O32-═S↓+SO2↑+H2O C Na+、Fe3+、SO42-、H2O2 能大量共存,粒子間不反應 D H+、Na+、Cl-、MnO4- 能大量共存,粒子間不反應 A.A B.B C.C D.D 組卷:1000引用:19難度:0.7 -
8.自然界中時刻存在著氮的轉化。實現氮氣按照一定方向轉化一直是科學領域研究的重要課題,如圖為N2分子在催化劑的作用下發(fā)生的一系列轉化示意圖。下列敘述正確的是( )
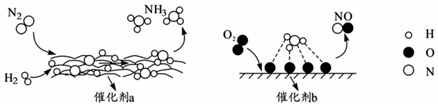
A.使用催化劑a、b均可以提高單位時間內生成物的產量 B.在催化劑b作用下,O2發(fā)生了氧化反應 C.催化劑a、b表面均發(fā)生了極性共價鍵的斷裂 D.N2→NH3,NH3→NO均屬于氮的固定 組卷:105引用:2難度:0.5
二、綜合分析題(共60分)
-
23.奶油中含有一種化合物A,可用作香料。在空氣中長時間攪拌奶油,A可轉化為化合物B.A發(fā)生的一系列化學反應如圖:
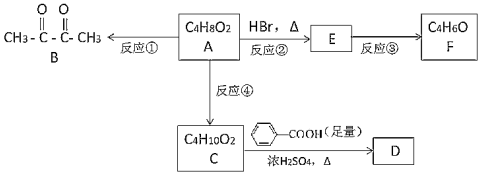
完成下列填空:
(1)寫出反應類型:反應①;反應②。
(2)寫出反應③所需的試劑與條件:。
(3)寫出結構簡式:F。
(4)寫出一種滿足下列要求的A的同分異構體的結構簡式:。
i.含有酯基 ii.能發(fā)生銀鏡反應
(5)寫出C→D反應的化學方程式:。
(6)C也能與乙二酸反應形成環(huán)狀化合物(C6H8O4),寫出該環(huán)狀化合物的結構簡式:。
(7)寫出以C為原料合成1,4-丁二醇(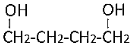 )的合成路線。。
)的合成路線。。
(合成路線常用的表示方式為:AB……反應試劑反應條件目標產物)反應試劑反應條件組卷:29引用:2難度:0.5 -
24.以印刷線路板的堿性蝕刻廢液(主要成分為[Cu(NH3)4]Cl2)或焙燒過的銅精煉爐渣(主要成分為CuO、SiO2少量Fe2O3)為原料均能制備CuSO4?5H2O晶體。
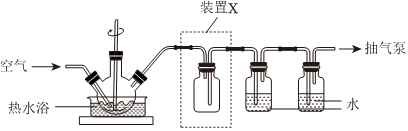
完成下列填空:
(1)取一定量蝕刻廢液和稍過量的NaOH溶液加入到如圖所示實驗裝置的三頸瓶中,在攪拌下加熱反應并通入空氣,待產生大量的黑色沉淀時停止反應,趁熱過濾、洗滌,得到CuO固體;所得固體經酸溶、結晶、過濾等操作,得到CuSO4?5H2O晶體。
①處用蝕刻廢液制備CuO反應的化學方程式:。
②檢驗CuO固體是否洗凈的實驗操作是。
③裝置圖中裝置X的作用是。
(2)已知該實驗中pH=3.2時,Fe3+完全沉淀;pH=4.7時,Cu2+開始沉淀。實驗中可選用的試劑:1.0mol?L-1 H2SO4、1.0mol?L-1 HCl、1.0mol?L-1 NaOH。以焙燒過的銅精煉爐渣為原料制備CuSO4?5H2O晶體時,請補充完整相應的實驗方案:取一定量焙燒過的銅精煉爐渣,,加熱濃縮、冷卻結晶、過濾、晾干,得到CuSO4?5H2O晶體。
(3)測定產品純度。測定過程中發(fā)生下列反應:2Cu2++4I-→2CuI↓+I2;2S2+I2→S4O2-3+2I-。準確稱取0.5000gCuSO4?5H2O樣品,加適量水溶解,轉移至碘量瓶中,加過量KI溶液并用稀H2SO4酸化,以淀粉溶液為指示劑,用0.1000mol?L-1Na2S2O3標準溶液滴定至終點,消耗Na2S2O3的溶液19.80mL。則CuSO4?5H2O樣品的純度為O2-6。組卷:57引用:3難度:0.5


