2015-2016學年廣東省中山市古鎮高中高二(上)第1周周測化學試卷
發布:2024/4/20 14:35:0
一、單選題:(每題3分,共18題,54分)
-
1.下列對化學反應的認識,錯誤的是( )
A.會引起化學鍵的變化 B.會產生新物質 C.必然引起物質狀態的變化 D.必然伴隨著能量的變化 組卷:700引用:85難度:0.9 -
2.下列反應屬于吸熱反應的是( )
A.炭燃燒生成一氧化碳 B.中和反應 C.鋅粒與稀硫酸反應制取H2 D.Ba(OH)2?8H2O與NH4Cl反應 組卷:226引用:24難度:0.9 -
3.下列變化一定為放熱的化學反應的是( )
A.H2O(g)═H2O(l)放出44 kJ熱量 B.△H>0的化學反應 C.形成化學鍵時共放出能量862 kJ的化學反應 D. 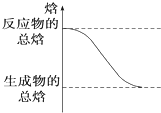
能量變化如圖所示的化學反應組卷:78引用:7難度:0.9 -
4.下列說法中正確的是( )
A.焓變是指1 mol物質參加反應時的能量變化 B.反應放熱時,△H>0;反應吸熱時,△H<0 C.在一個確定的化學反應關系中,反應物的總焓與生成物的總焓一定不同 D.在一個確定的化學反應關系中,反應物的總焓總是高于生成物的總焓 組卷:65引用:8難度:0.9 -
5.在相同條件下,下列兩個反應放出的熱量分別用△H1和△H2表示:
2H2(g)+O2(g)═2H2O(g)△H1
2H2(g)+O2(g)═2H2O(l)△H2
則( )A.△H2>△H1 B.△H1>△H2 C.△H1=△H2 D.無法確定 組卷:129引用:9難度:0.7 -
6.已知:H2(g)+F2(g)═2HF(g)△H=-270kJ?mol-1,下列說法正確的是( )
A.2 L氟化氫氣體分解成1 L氫氣與1 L氟氣吸收270 kJ熱量 B.1 mol氫氣與1 mol氟氣反應生成2 mol液態氟化氫放出的熱量小于270 kJ C.在相同條件下,1 mol氫氣與1 mol氟氣的能量總和大于2 mol氟化氫氣體的能量 D.1個氫氣分子與1個氟氣分子反應生成2個氟化氫氣體分子放出270 kJ熱量 組卷:22引用:16難度:0.9 -
7.由氫氣和氧氣反應生成1mol水蒸氣放出241.8kJ的熱量,1g水蒸氣轉化為液態水放出2.45kJ的熱量,則下列熱化學方程式書寫正確的是( )
A.H2(g)+ O2(g)=H2O(l);△H=-285.9 kJ/mol12B.H2(g)+ O2(g)=H2O(l);△H=-241.8 kJ/mol12C.H2(g)+ O2(g)=H2O(l);△H=+285.9 kJ/mol12D.H2(g)+ O2(g)=H2O(l);△H=+241.8 kJ/mol12組卷:74引用:8難度:0.9
二、填空題:
-
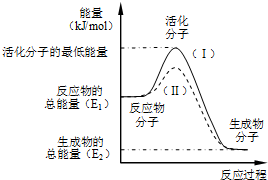 22.在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子稱為活化分子,使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用kJ/mol表示.請認真觀察如圖,然后回答問題.
22.在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子稱為活化分子,使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用kJ/mol表示.請認真觀察如圖,然后回答問題.
(1)圖中所示反應是(填“吸熱”或“放熱”)反應,該反應的△H=(用含E1、E2的代數式表示)
(2)已知熱化學方程式:H2(g)+O2(g)═H2O(g)△H=-241.8kJ/mol,該反應的活化能為167.2kJ/mol,則其逆反應的活化能為12.
(3)對于同一反應,圖中虛線(Ⅱ)與實線(Ⅰ)相比,活化能,活化分子百分數,反應速率,你認為最可能的原因是它對反應熱是否有影響?,原因是.組卷:15引用:2難度:0.3 -
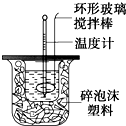 23.利用如圖裝置測定中和熱的實驗步驟如下:
23.利用如圖裝置測定中和熱的實驗步驟如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小燒杯中,測出硫酸溫度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一溫度計測出其溫度;
③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測出混合液最高溫度。
回答下列問題:
(1)寫出稀硫酸和稀氫氧化鈉溶液反應表示中和熱的熱化學方程式(中和熱數值為57.3kJ/mol):。
(2)倒入NaOH溶液的正確操作是(從下列選出)。
A.沿玻璃棒緩慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸與NaOH溶液混合均勻的正確操作是(從下列選出)。
A.用溫度計小心攪拌 B.揭開硬紙片用玻璃棒攪拌
C.輕輕地振蕩燒杯 D.用套在溫度計上的環形玻璃棒輕輕地攪動
(4)實驗數據如下表:
①請填寫下表中的空白:
②近似認為0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比熱容c=4.18J/(g?℃)。則中和熱△H=溫度
實驗次數起始溫度t1℃ 終止溫度t2/℃ 溫度差平均值(t2-t1)/℃ H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 (取小數點后一位)。
③上述實驗數值結果與57.3kJ/mol有偏差,產生偏差的原因可能是(填字母)。
a.實驗裝置保溫、隔熱效果差
b.量取NaOH溶液的體積時仰視讀數
c.分多次把NaOH溶液倒入盛有硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后直接測定H2SO4溶液的溫度。組卷:17引用:2難度:0.5


