2021-2022學年福建省泉州一中高三(上)月考化學試卷(10月份)
發布:2024/11/14 4:0:2
一、單選題(共10小題,每題4分,共40分)
-
1.某中德聯合研究小組設計制造了一種“水瓶”,用富勒烯(C60)的球形籠子作“瓶體”,一種磷酸鹽作“瓶蓋”,恰好可將一個水分子關在里面。下列說法正確的是( )
A.“水瓶”是純凈物 B.金剛石、石墨和C60互稱為同位素 C.磷酸鈣是難溶性弱電解質 D.一定條件下石墨轉化為C60是化學變化,屬于有單質參加的非氧化還原反應 組卷:7引用:1難度:0.6 -
2.下列反應中改變反應物用量不會導致產物發生變化的是( )
A.向硫酸氫鈉溶液中滴加氫氧化鋇溶液 B.向Ca(OH)2溶液中通入SO2 C.向碳酸氫鈣溶液中滴加澄清石灰水 D.向FeI2溶液中加入氯水 組卷:17引用:1難度:0.6 -
3.化工生產中用次磷酸鈉(NaH2PO2)進行化學鍍銅,具有體系穩定性好、無毒性等優點,反應原理為CuSO4+2NaH2PO2+2NaOH═Cu+2NaH2PO3+Na2SO4+H2↑。下列說法正確的是( )
A.NaH2PO2中P元素的化合價為+1價 B.反應中氧化劑只有CuSO4 C.上述化學反應中每轉移1mole-,生成H2 11.2L(標準狀況) D.已知H3PO2與足量NaOH反應只生成NaH2PO2,則NaH2PO2為酸式鹽 組卷:15引用:3難度:0.6 -
4.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.含4molHNO3的濃硝酸與足量銅充分反應,生成NO2的分子數為2NA B.標準狀況下,4.48LSO2中含有的氧原子數為0.6NA C.116gFe3O4被完全還原為Fe2+時轉移的電子數為NA D.50mL18mol?L-1的H2SO4溶液中含有H+數為1.8NA 組卷:7引用:1難度:0.5 -
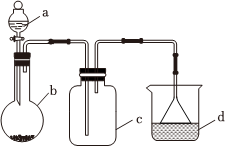 5.實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置)。僅用此裝置和表中提供的物質完成相關實驗),最合理的選項是( )
5.實驗室中某些氣體的制取、收集及尾氣處理裝置如圖所示(省略夾持和凈化裝置)。僅用此裝置和表中提供的物質完成相關實驗),最合理的選項是( )選項 a中的物質 b中的物質 c中的物質 d中的物質 A 濃硫酸 Na2SO3 SO2 NaOH溶液 B 濃氨水 CaO NH3 H2O C 濃鹽酸 二氧化錳 Cl2 NaOH溶液 D 稀硝酸 Cu NO2 H2O A.A B.B C.C D.D 組卷:26引用:3難度:0.8
二、填空題(共5道大題,共60分)
-
14.硫鐵礦的主要成分為FeS2,工業上常用硫鐵礦在空氣中煅燒產氣來制備硫酸,該過程中的燒渣可用于制備鐵紅、綠礬等。現以硫鐵礦燒渣(主要成分為Fe2O3、FeO,還含有少量的Al2O3、SiO2雜質)為原料、氨水為沉淀劑制備鐵紅顏料的流程如圖所示:

根據所學知識,回答下列問題:
(1)寫出FeS2高溫煅燒生成Fe2O3的化學方程式,其中氧化產物為(填化學式)。
(2)“浸取液Ⅰ”中加入H2O2的目的是,發生反應的離子方程式為。
(3)“操作Ⅰ”的名稱為。
(4)在加入氨水沉淀時,調節pH可使得Fe3+沉淀而Al3+不沉淀。“濾液Ⅱ”中溶質的主要成分為(填化學式)。寫出獲得“濾渣Ⅱ”的離子方程式:。組卷:45引用:4難度:0.4 -
15.以Cl2和空氣(不參與反應)按體積比1:3混合通入含水8%的碳酸鈉中制備Cl2O,并用水吸收Cl2O(不含Cl2)制備次氯酸溶液,其主要實驗裝置如圖:

已知:Cl2O為棕黃色氣體,沸點約3.8℃,42℃以上分解生成Cl2和O2,易溶于水并與水反應生成HClO。
(1)寫出裝置A中發生的反應的化學方程式。
(2)裝置B中儀器a的名稱是,反應的離子方程式為。
(3)為提高原料的利用率,使Cl2充分反應,裝置A在操作時可采取的措施為。
(4)實驗過程中,裝置B需放在冷水中,其目的是。
(5)各裝置的連接順序為A→→→→(填裝置大寫字母代號)
(6)已知HClO+2Fe2++H+═Cl-+2Fe3++H2O;MnO4-+5Fe2++8H+═5Fe3++Mn2++4H2O。用下列實驗方案測定裝置E所得溶液中次氯酸的物質的量濃度:量取10mL上述次氯酸溶液,并稀釋至100mL,再從其中取出10.00mL于錐形瓶中,并加入10.00mLFeSO40.80mol?L-1的溶液,充分反應后,用0.05000mol?L-1的酸性KMnO4溶液滴定至終點,消耗KMnO4溶液24.00mL,則原次氯酸溶液的濃度為(保留4位有效數字)。組卷:4引用:2難度:0.6


