2021-2022學年黑龍江省大慶實驗中學高三(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(1-10題,每題2分;11-18題,每題3分)
-
 1.舉世矚目的2012年奧運會在倫敦召開,有一種有機物,因其酷似奧林匹克旗中的五環.科學家稱其為奧林匹克烴,下列有關奧林匹克烴的說法正確的是( )
1.舉世矚目的2012年奧運會在倫敦召開,有一種有機物,因其酷似奧林匹克旗中的五環.科學家稱其為奧林匹克烴,下列有關奧林匹克烴的說法正確的是( )A.該烴的一氯代物只有六種 B.該烴分子中只含非極性鍵 C.該烴完全燃燒生成H2O的物質的量小于CO2的物質的量 D.該烴屬于苯的同系物 組卷:31引用:6難度:0.7 -
2.2020年11月“嫦娥五號”成功著陸月球,展示了以芳綸為主制成的五星紅旗,用SiC增強鋁基材料鉆桿“挖土”,實現了中國首次月球無人采樣返回。研究表明月球表面的“土壤”主要含有氧,硅、鋁、鐵、鎂、鈣和鈉等元素。下列有關說法正確的是( )
A.月球表面的“土壤”所含金屬元素鎂和鋁均可以通過電解其熔融氯化物進行冶煉 B.制作五星紅旗用的芳綸為合成纖維,灼燒具有燒焦羽毛的氣味 C.SiC又稱金剛砂,屬于有機合成高分子材料 D.“嫦娥五號”使用的鋰離子電池組工作時是將化學能轉變成電能 組卷:15引用:2難度:0.8 -
3.下列關于新冠病毒說法錯誤的是( )
A.含有病毒的飛沫分散在空氣中形成的分散系為氣溶膠 B.N95口罩所使用的聚丙烯材料屬于天然纖維 C.用于盛裝新冠疫苗的中硼硅玻璃管屬于硅酸鹽材質,既耐低溫,又耐強酸 D.用電解食鹽水制取的次氯酸鈉噴灑房間能殺死新冠肺炎病毒 組卷:6引用:2難度:0.6 -
4.檢驗黑木耳中的鐵離子的步驟為:灼燒黑木耳→加酸溶解→過濾→取濾液檢驗,所選擇的裝置(夾持裝置已略去)及操作正確的是( )
A. 
灼燒木耳B. 
加酸后攪拌溶解C. 
過濾得濾液D. 
檢驗濾液中鐵離子組卷:6引用:2難度:0.7 -
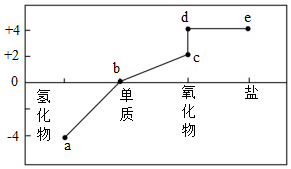 5.部分含碳物質的分類與相應碳元素的化合價關系如圖所示。下列說法錯誤的是( )
5.部分含碳物質的分類與相應碳元素的化合價關系如圖所示。下列說法錯誤的是( )A.a中可能含有非極性鍵 B.b存在多種同素異形體 C.c不屬于酸性氧化物 D.d轉化為e可通過化合反應實現 組卷:16引用:1難度:0.6 -
6.鍺和鋁在周期表中位于對角線位置,兩者性質很相似.下列關于鍺和鍺的化合物性質推斷正確的是( )
A.鍺不能與強堿溶液反應 B.氫氧化鍺有兩性 C.氧化鍺易溶于水 D.氧化鍺的化學式為Ge2O3 組卷:47引用:4難度:0.9 -
7.已知電離平衡常數:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有關離子反應或離子方程式的敘述中,正確的是( )
A.常溫下,中性溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 B.向含有0.4mol FeI2的溶液中通入0.3mol Cl2充分反應:4Fe2++2I-+3Cl2═4Fe3++6Cl-+I2 C.向NaClO溶液中通入少量二氧化碳的離子方程式:ClO-+CO2+H2O═HClO+HCO3- D.向FeBr2溶液中滴加少量氯水,再加入CCl4溶液振蕩,靜置,有機層呈橙色 組卷:39引用:3難度:0.5
二、填空題
-
21.氯氣是一種重要的化工原料。
(1)由氧化物經氯化作用生成氯化物是工業生產氯化物的常用方法,例如,工業上,常采用“加碳氯化”的方法以高鈦渣(主要成分為TiO2)為原料生產TiCl4。已知:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4 kJ?mol-1;KI=3.4×10-29
2C(s)+O2(g)=2CO(g)△H2=-220.9 kJ?mol-1;KⅡ=1.2×1048
沸騰爐中加碳氯化生成TiCl4(g)和CO(g)的熱化學方程式:。
結合數據說明氯化過程中加碳的理由。
(2)Cl2合成有機物時會產生副產物HCl。4HCl+O22Cl2+2H2O,可實現氯的循環利用。CuO/CuCl400℃
①若該反應在體積不變的密閉容器中發生,當反應達平衡時,下列敘述正確的是
a.v (HCl)=2 v(Cl2)
b.4v正(HCl)=v逆(O2)
c.又加入1mol O2,達新平衡時,HCl的轉化率增大
d.分離出H2O,達新平衡時,v正(HCl)增大
②如圖是該反應兩種投料比[分別為4:1和2:1]下,反應溫度對HCl平衡轉化率影響的曲線。下列敘述正確的是n(HCl)n(O2)。
a.該反應的正反應是放熱反應
b.其他條件不變,升高溫度,平衡常數K值增大
c.若平衡常數K值變大,達新平衡前v逆始終減小
d.若平衡常數K值變大,則平衡向正反應方向移動
(3)在一定溫度下,氯氣溶于水的過程及其平衡常數為:
Cl2(g)?Cl2(aq) K1=c(Cl2)P
Cl 2(aq)+H2O(l)?H+ (aq)+Cl- (aq)+HClO(aq) K2
其中p為Cl2(g)的平衡壓強,c(Cl2)為Cl2在水溶液中的平衡濃度。
①Cl2(g)?Cl2(aq)的焓變△H10。(填”>”、“=”或“<”)
②平衡常數K2的表達式為K2=。
③氯氣在水中的溶解度(以物質的量濃度表示)為c,則c=。(用平衡壓強p和上述平衡常數表示,忽略HClO的電離)
(4)在一定溫度下,以I2為催化劑,氯苯和Cl2在CS2中發生平行反應,分別生成鄰二氯苯和對二氯苯,兩產物濃度之比與反應時間無關。反應物起始濃度均為0.5 mol?L-1,反應30 min測得氯苯15%轉化為鄰二氯苯,25%轉化為對二氯苯。保持其他條件不變,若要提高產物中鄰二氯苯的比例,可采用的措施是。
A.適當提高反應溫度
B.改變催化劑
C.適當降低反應溫度
D.改變反應物濃度組卷:19引用:1難度:0.7 -
22.溴水中存在化學平衡:Br2+H2O═HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三種物質(如圖所示)。 已知:R-CH2Cl+NaOH (水溶液)→R-CH2OH+NaCl

回答下列問題:
(1)寫出B中所含官能團名稱,指出③的反應類型,寫出I的結構簡式。
(2)寫出反應 ①的化學方程式。寫出反應 ②的化學方程式。
(3)以C2H5Br為原料,其它無機試劑任選,寫出制備乙酸乙酯的合理流程圖,注明試劑和條件。注:合成路線的書寫格式參照圖。組卷:26引用:3難度:0.7


