2023年河北省邯鄲市高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.非物質文化遺產是我國優秀傳統文化的重要組成部分。下列說法正確的是( )
A.武強木版年畫——印刷過程發生了化學變化 B.傳統紡織工藝——棉花的主要成分為蛋白質 C.易水硯制作技藝——沉積巖為新型無機非金屬材料 D.煙花爆竹制作工藝——燃放煙花時發生了氧化還原反應 組卷:24引用:2難度:0.7 -
2.科學家開發了Mo-VOx催化劑,在180℃下以氧氣為氧化劑將乳酸甲酯(a)催化氧化成丙酮酸甲酯(b)。下列敘述正確的是( )
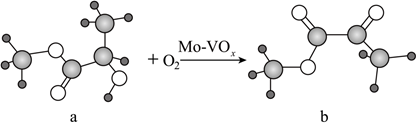
A.a、b兩物質中所含官能團完全相同 B.上述變化中乳酸甲酯發生了氧化反應 C.a、b兩物質都不能與水分子形成氫鍵 D.b在核磁共振氫譜上只有1組峰 組卷:16引用:3難度:0.7 -
3.在制備和提純乙酸乙酯的實驗過程中,下列裝置或操作不會涉及的是( )
A. 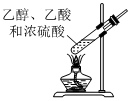
B. 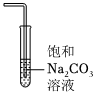
C. 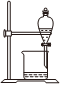
D.  組卷:98引用:4難度:0.8
組卷:98引用:4難度:0.8 -
4.氟與堿的反應不同于其他鹵素與堿的反應,例如F2與NaOH稀溶液可發生反應:2F2(g)+2NaOH(aq)=2NaF(aq)+OF2(g)+H2O(l)。設NA為阿伏加德羅常數的值。下列說法錯誤的是( )
A.NaF溶液顯酸性 B.H2O分子中O的價層電子對數為4 C.含0.1molNaOH的溶液中,Na+的數目為0.1NA D.OF2分子中每個原子均達到8電子穩定結構 組卷:26引用:2難度:0.7 -
5.水體中的局部氮循環如圖所示。下列說法錯誤的是( )
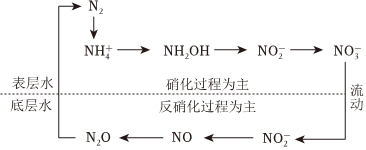
A.N2→ 屬于氮的固定NH+4B.圖示轉化過程中N元素表現出7種化合價 C.硝化過程中含N物質被氧化,反硝化過程中含N物質被還原 D.在 、NH2OH、NH+4和NO-2中N原子的雜化方式不完全相同NO-3組卷:31引用:3難度:0.7 -
6.物質的結構決定物質的性質。設NA為阿伏加德羅常數的值。下列說法錯誤的是( )
A.DNA通過氫鍵結合成穩定的雙螺旋結構 B.46g由二甲醚(CH3OCH3)和乙醇組成的混合物中,雜化方式為sp2雜化的原子數為2NA C.鍵角: >NF3>P4CO2-3D.基態Mn原子中,兩種自旋狀態的電子數之比為2:3 組卷:28引用:2難度:0.7
二、非選擇題:本題共4小題,共58分。
-
17.鈷是生產電池材料、高溫合金、磁性材料及催化劑的重要原料。一種以濕法煉鋅凈化渣(含有Co、Zn、Fe、Cu、Pb等金屬及其氧化物)為原料提取鈷的工藝流程如圖1所示:
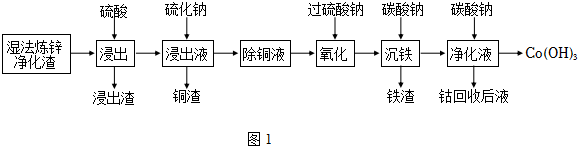
已知:①常溫下,Ksp(CuS)=8.9×10-36,Ksp(CoS)=1.8×10-22。
②溶液的氧化還原電位為正表示該溶液顯示出一定的氧化性。氧化還原電位越高,氧化性越強;電位越低,氧化性越弱。
回答下列問題:
(1)基態Co原子的價層電子軌道表示式為。
(2)“浸出渣”的主要成分為(填化學式)。工業上,在“浸出”過程中,常選用硫酸浸取,而不用鹽酸,原因是。
(3)Na2S常用作沉淀劑,在“銅渣”中檢測不到Co2+,“除銅液”中Co2+濃度為0.18mol?L-1,則此時溶液的pH<[已知常溫下,飽和H2S水溶液中存在關系式:c2(H+)?c(S2-)=1.0×10-22(mol?L-1)3]。
(4)“氧化”過程中,Na2S2O8與Fe2+發生反應的離子方程式為。
(5)“沉鐵”過程中,Na2CO3的作用是。
(6)Co元素的存在形式的穩定區域與溶液pH的關系如圖2(E-pH圖)所示,在溶液pH=5時,Na2S2O8能將Co2+氧化,寫出該反應的離子方程式:;以1噸濕法煉鋅凈化渣(Co的質量分數為w%)為原料提取出mkgCo(OH)3。在提取過程中鈷的損失率為(填含w、m的表達式)%。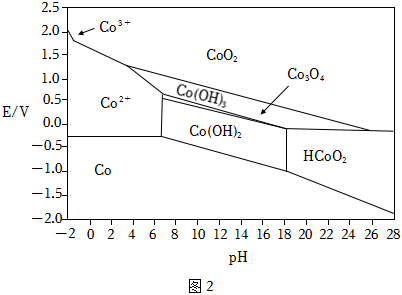 組卷:45引用:2難度:0.6
組卷:45引用:2難度:0.6 -
18.研究CO、CO2在一定條件下與H2催化合成CH4等有機化工產品,對實現“碳中和”目標具有重要的意義。在一定條件下CO(g)與H2(g)可發生如下反應:
反應Ⅰ:CO(g)+3H2(g)?CH4(g)+H2O(g)△H1=-206.4kJ?mol-1
反應Ⅱ:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H2
反應Ⅲ:CO2(g)+H2(g)?CO(g)+H2O(g)△H3=+41.2kJ?mol-1
(1)部分物質的標準生成焓數據如表所示:
則x=物質 CO(g) H2(g) CH4(g) H2O(g) 標準生成焓/(kJ?mol-1) -110 0 -74.6 x ;△H2=kJ?mol-1。
(2)一定溫度范圍內反應I和反應Ⅱ的lgKp-的線性關系如圖1所示。1T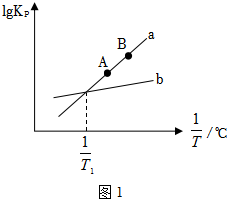
①依據圖像,可知T1℃時,反應Ⅲ的平衡常數Kp3=。
②圖中v正(A)(填“>”、“<”或“=”)v逆(B)。
(3)①恒溫(323K)恒壓(p)條件下,在密閉容器中起始時按n(H2):n(CO2)=1:1投料進行反應(僅發生反應Ⅱ和反應Ⅲ),CO2初始分壓分別為p0-(a)MPa、p0-(b)MPa、p0-(c)MPa,測得CO2的壓強轉化率α(CO2)[已知:氣體A的壓強轉化率表示為α(A)=(1-)×100%,p0MPa為A的初始分壓,p1MPa為某時刻A的分壓]與時間(t)的關系如圖2,則p0-(a)、p0-(b)、p0-(c)由大到小的順序為p1p0。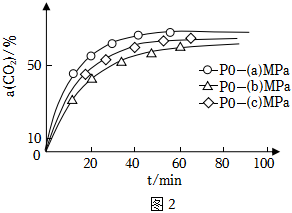
②在密閉容器中起始時按n(H2):n(CO2)=3:1投料,分別在壓強為1MPa和5MPa的恒壓下進行反應(兩壓強下均只發生反應Ⅱ和反應Ⅲ)。恒壓條件下反應溫度對平衡體積分數δ(x)[x為CO或CH4,δ(x)=×100%]的影響如圖3所示。V(x)V(CO)+V(CH4)+V(CO2)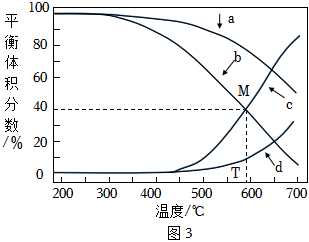
則在1MPa時,表示CH4和CO的平衡體積分數隨溫度變化關系的曲線依次是(填“a”、“b”、“c”或“d”,下同)和;在T℃、一定壓強下,反應在M點達到化學平衡,平衡時CH4的分壓p(CH4)=MPa,反應Ⅲ的平衡常數Kp=。組卷:45引用:3難度:0.6


