2021-2022學年浙江省溫州市瑞安中學高二(下)開學化學試卷
發布:2024/11/10 22:0:2
一、選擇題(本題共25個小題,每小題2分,共50分。在每小題給出的四個選項中,只有一個選項符合題意)
-
1.下列物質屬于強電解質的是( )
A.H2SO3 B.Cu(OH)2 C.NaHCO3 D.CH4 組卷:4引用:2難度:0.7 -
2.下列表示不正確的是( )
A.乙烷的實驗式:CH3 B.乙烯的球棍模型: 
C.二氧化碳的電子式: 
D.Cl2O的結構式:  組卷:23引用:2難度:0.7
組卷:23引用:2難度:0.7 -
3.下列說法正確的是( )
A.氯仿和三氯甲烷是同一種物質 B.C2H4和C6H12一定互為同系物 C.NO和NO2互為同素異形體 D.16O2和18O3互為同位素 組卷:9引用:2難度:0.9 -
4.下列說法正確的是( )
A.聚異戊二烯不能發生加成反應 B.乙醇可使得酸性高錳酸鉀溶液褪色 C.甘氨酸既能與酸反應,也能與堿反應,均生成鹽和水 D.液態油脂與氫氣加成可生產奶油,奶油相較于液態油脂更容易變質 組卷:2引用:2難度:0.8 -
5.關于反應5K2S2O8+2MnSO4+8H2O═2KMnO4+8H2SO4+4K2SO4的說法正確的是( )
A.K2S2O8發生氧化反應 B.KMnO4是還原產物 C.消耗3.6gH2O時,轉移0.25mol電子 D.氧化劑和還原劑物質的量之比是2:5 組卷:7引用:3難度:0.6 -
6.下列敘述正確的是( )
A.M電子層有s、p共2個能級,最多能容納8個電子 B.可能存在核外電子排布式為1s22s22p63s23p64s24p1的基態原子 C.無論哪一電子層的s能級最多容納的電子數均為2 D.任一電子層都有s、p能級,但不一定有d能級 組卷:11引用:2難度:0.7 -
7.下列說法正確的是( )
A.常溫下鐵與濃硫酸不反應 B.銅粉與硫粉加熱反應可生成硫化銅 C.二氧化硅是一種酸性氧化物,不能和酸發生反應 D.濃硫酸具有良好的吸水性,能用濃硫酸干燥SO2氣體 組卷:26引用:2難度:0.8 -
8.下列說法中正確的是( )
A.在潮濕環境下,合金都易發生電化學腐蝕 B.汽車尾氣中的氮氧化物是汽油不完全燃燒造成的 C.Fe3O4是一種紅棕色粉末,常用來作油漆的紅色顏料 D.通過電解熔融氧化鋁的方法,可以制備金屬鋁 組卷:9引用:2難度:0.8 -
9.下列“類比”結果正確的是( )
A.根據同周期元素的電負性變化趨勢,推出Ar的電負性比Cl大 B.CO2與足量Na2O2反應生成碳酸鈉,則SO2與足量Na2O2反應生成亞硫酸鈉 C.Cu(OH)2可以溶解在濃氨水中,則Fe(OH)3也可以溶解在濃氨水中 D.CH4的空間構型為正四面體型,則C(CH3)4碳骨架的空間構型為正四面體型 組卷:3引用:1難度:0.6 -
10.用下列實驗裝置進行相應的實驗,能達到實驗目的的是( )
A. 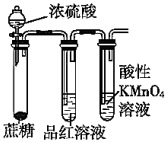
利用如圖驗證濃硫酸具有脫水性、強氧化性,SO2具有漂白性、還原性B. 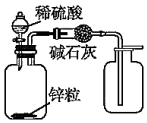
利用如圖制備并收集干燥的氫氣C. 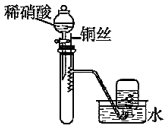
利用如圖制備并收集少量的NO2D. 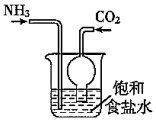
利用如圖制取碳酸氫鈉組卷:5引用:1難度:0.5
二、非選擇題(本題共6個小題,共50分)
-
30.氨氣廣泛應用于化肥、制藥、合成纖維等領域。
Ⅰ.工業上可由氫氣和氮氣合成氨氣。若用 、
、 、
、 、
、 分別表示N2、H2、NH3和催化劑,則在催化劑表面合成氨的過程如圖1所示:
分別表示N2、H2、NH3和催化劑,則在催化劑表面合成氨的過程如圖1所示: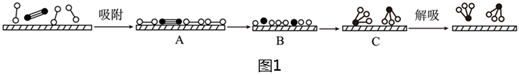
(1)吸附后,能量狀態最高的是(填序號)。
(2)結合上述過程,一定溫度下在固體催化劑表面進行NH3的分解實驗,發現NH3的分解速率與濃度的關系如圖2所示。從吸附和解吸過程分析,c0前反應速率增加的原因可能是;c0之后反應速率降低的原因可能是。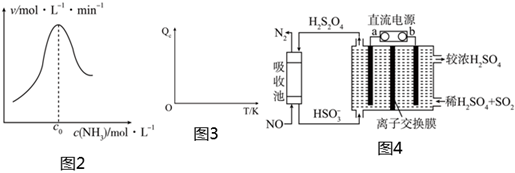
Ⅱ.利用NH3在催化劑(V2O5-WO3/TiO2)作用下將NOx還原為N2是目前應用最為廣泛的氮氧化物NOx的凈化方法,其原理是:
主反應:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)ΔH1
副反應:4NH3(g)+3O2(g)?2N2(g)+6H2O(g)ΔH2
(3)根據蓋斯定律可得:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)ΔH3。則ΔH3=(用含ΔH1、ΔH2的式子表示)。
(4)向脫硝反應的體系中添加NH4NO3可顯著提高NO脫除率,原因可用一組離子方程式表示,請補充其中的1個離子方程式。(已知含氮微粒最終轉化為N2)
①NO3-+NO=NO2+NO2-
②NO2+2NH4+=NO2(NH4+)2;。
③NO2(NH4+)2+NO=2N2+3H2O+2H+
④NH3+H+=NH4+
(5)化學反應的濃度商(用符號Qc表示)是可逆反應進行到一定程度,產物濃度的系數次方的乘積與反應物濃度系數次方的乘積之比;達平衡時,濃度商就等于平衡常數K。若反應容器的體積固定不變,在坐標系(圖3)中畫出從常溫時通入4molNH3和6molNO開始[僅發生反應:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)ΔH3<0],隨溫度(T/K)不斷升高,濃度商Qc的變化趨勢圖。
(6)氮氧化物脫除還可以利用電化學原理處理,利用如圖4裝置可同時吸收SO2和NO。已知:H2S2O4是一種弱酸。陰極的電極反應式為,若沒有能量損失,相同條件下,SO2和NO的體積比為時,兩種氣體都能被完全處理。組卷:23引用:2難度:0.6 -
31.Pd/Al2O3是常見的汽車尾氣催化劑。一種廢Pd/Al2O3納米催化劑主要成分及含量:Pd 0.3%,Al2O3 92.8%,SiO2 5.0%,Co、Pt和炭共約1.0%。采用如圖1工藝從中提取金屬Co和Pd。
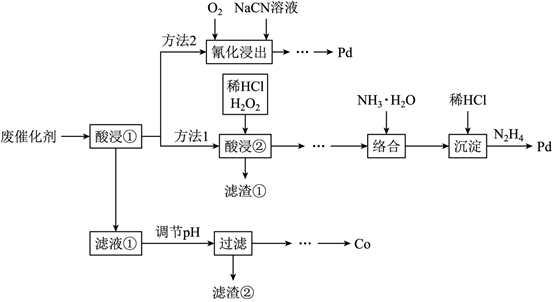
請回答下列問題:
(1)方法2比方法1后續回收流程相對簡單,但工業上不常用方法2,從綠色化學角度分析原因是。
(2)“酸浸②”時,Pt和Pd分別轉化為PtCl42-和PdCl42-,請寫出Pd轉化為PdCl42-的離子方程式為。
(3)為了精準投料,需要測定“絡合”過程加入的氨水溶液的濃度。待測液用堿式滴定管量取(如圖2),選出正確操作完成“量取”操作:蒸餾水洗滌→加入待裝液3~5mL→→→→→d。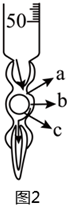
a.加液至“0”刻度以上2~3cm
b.傾斜轉動滴定管,使液體潤濕滴定管內壁,擠壓玻璃球,放液
c.調整至“0”或“0”刻度以下,靜止1min,讀數
d.將滴定管尖端插入錐形瓶內約1cm,放一定體積液,讀數
e.右手拿住滴定管使它傾斜30°,左手迅速打開活塞
f.橡皮管向上彎曲,擠壓玻璃球a處,放液
g.橡皮管向上彎曲,擠壓玻璃球b處,放液
h.橡皮管向上彎曲,擠壓玻璃球c處,放液
(4)“絡合”過程后得到Pd(NH3)42+和Pt(NH3)42+,“沉淀”時,攪拌滴加鹽酸調節pH將[Pd(NH3)4]Cl2轉化為[Pd(NH3)2]Cl2沉淀,結合平衡移動原理解釋實現該轉化的原因。
(5)已知:常溫下,Ksp[Co(OH)2]=10-15,Ksp[Al(OH)3]=10-32。若濾液①中c(Co2+)=0.01 mol?L-1,則分離出Al(OH)3沉淀需調節pH的范圍是(當離子濃度小于1.0×10-5mol?L-1時認為已沉淀完全),調節pH可以選擇的最佳物質是(填序號)
A.Al2O3
B.NaOH
C.CoO
D.NaHCO3組卷:4引用:2難度:0.5


