2022-2023學(xué)年北京師大附中高二(上)期中化學(xué)試卷
發(fā)布:2024/11/27 13:0:2
一、選擇題(21道小題,共42分,每小題只有1個(gè)選項(xiàng)符合題意)
-
1.在3A(g)+2B(g)?C(g)+4D(g)反應(yīng)中,表示該反應(yīng)速率最快的是( )
A.v(A)=0.9mol?L-1?s-1 B.v(B)=0.3mol?L-1?s-1 C.v(C)=0.4mol?L-1?s-1 D.v(D)=0.8mol?L-1?s-1 組卷:40引用:1難度:0.8 -
2.某溫度下在容積固定的密閉容器中進(jìn)行反應(yīng)H2(g)+I2(g)?2HI(g),下列現(xiàn)象能表明反應(yīng)已達(dá)平衡的是( )
A.v(H2)正=2v(HI)逆 B.容器內(nèi)氣體密度不再改變 C.容器內(nèi)氣體顏色不再改變 D.容器內(nèi)氣體壓強(qiáng)不再改變 組卷:27引用:1難度:0.7 -
3.已知:①2C(s)+O2(g)═2CO(g)△H=-220kJ?mol-1②氫氣燃燒的能量變化示意圖:
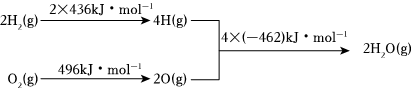
下列說法正確的是( )A.1molC(s)完全燃燒放出110 kJ的熱量 B.H2(g)+ O2(g)═H2O(g)△H=-480 kJ?mol-112C.C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ?mol-1 D.欲分解2 mol H2O(l),至少需要提供4×462 kJ的熱量 組卷:66引用:11難度:0.5 -
4.下列說法不正確的是( )
A.水凝結(jié)成冰的過程中,體系的ΔS<0 B.NH4NO3溶于水吸熱,說明其溶于水不是自發(fā)過程 C.化學(xué)反應(yīng)自發(fā)進(jìn)行的方向,與反應(yīng)的ΔH和ΔS都有關(guān) D.發(fā)生離子反應(yīng)的條件之一是生成氣體,此過程是一個(gè)ΔS>0的過程 組卷:31引用:1難度:0.7 -
5.硫代硫酸鈉溶液與稀硫酸反應(yīng)的化學(xué)方程式為:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各組實(shí)驗(yàn)中最先出現(xiàn)渾濁的是( )
實(shí)驗(yàn) 反應(yīng)溫度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/(mol?L-1) V/mL c/(mol?L-1) V/mL A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.1 10 0.1 5 D 35 5 0.2 5 0.2 10 A.A B.B C.C D.D 組卷:20引用:8難度:0.6 -
6.下列事實(shí)不能用平衡移動(dòng)原理解釋的是( )
A.開啟啤酒瓶后,瓶中馬上泛起大量泡沫 B.由NO2(g)、N2O4(g)組成的平衡體系壓縮體積后顏色變深 C.實(shí)驗(yàn)室制取乙酸乙酯時(shí),將乙酸乙酯不斷蒸出 D.實(shí)驗(yàn)室用排飽和食鹽水法收集Cl2 組卷:37引用:4難度:0.7 -
7.下列物質(zhì)中,屬于弱電解質(zhì)的是( )
A.氨水 B.二氧化硫 C.冰醋酸 D.甲烷 組卷:17引用:2難度:0.6 -
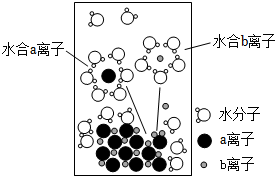 8.NaCl是我們生活中必不可少的物質(zhì)。將NaCl溶于水配成1mol?L-1的溶液,溶解過程如圖所示,下列說法正確的是( )
8.NaCl是我們生活中必不可少的物質(zhì)。將NaCl溶于水配成1mol?L-1的溶液,溶解過程如圖所示,下列說法正確的是( )A.b的離子為Cl- B.溶液中含有NA個(gè)Na+ C.水合b離子的圖示不科學(xué) D.40℃時(shí)該溶液的pH小于7,是由于Na+水解所致 組卷:47引用:2難度:0.7 -
9.下列說法中正確的是( )
A.100℃時(shí),pH為6的純水為酸性 B.c(H+)>c(OH-)的水溶液一定呈酸性 C.pH=2的鹽酸和醋酸分別加水稀釋100倍,所得溶液中醋酸的pH大 D.常溫下,將1mLpH=9的氫氧化鈉溶液稀釋至1000mL,所得溶液pH=6 組卷:53引用:1難度:0.8
二、解答題(6道小題,共58分)
-
 26.氫能是一種極具發(fā)展?jié)摿Φ那鍧嵞茉矗珻H4-H2O催化重整是目前大規(guī)模制取氫氣的重要方法。
26.氫能是一種極具發(fā)展?jié)摿Φ那鍧嵞茉矗珻H4-H2O催化重整是目前大規(guī)模制取氫氣的重要方法。
(1)CH4-H2O催化重整:
反應(yīng)Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+210kJ?mol-1
反應(yīng)Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41kJ?mol-1
①提高CH4平衡轉(zhuǎn)化率的條件是。
a.增大壓強(qiáng) b.加入催化劑 c.增大水蒸氣濃度
②CH4、H2O催化重整生成CO2、H2的熱化學(xué)方程式是。
③在密閉容器中,將2.0mol CO與8.0mol H2O混合加熱到800℃發(fā)生反應(yīng)Ⅱ,達(dá)
到平衡時(shí)CO的轉(zhuǎn)化率是80%,其平衡常數(shù)為。
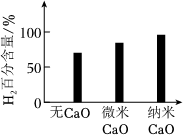
(2)實(shí)驗(yàn)發(fā)現(xiàn),其他條件不變,相同時(shí)間內(nèi),向催化重整體系中投入一定量的CaO可以明顯提高H2的百分含量。做對(duì)比實(shí)驗(yàn),結(jié)果如圖所示:
①投入CaO時(shí),H2百分含量增大的原因是:。
②投入納米CaO時(shí),H2百分含量增大的原因是:。
(3)反應(yīng)中催化劑活性會(huì)因積炭反應(yīng)而降低,相關(guān)數(shù)據(jù)如下表:
①研究發(fā)現(xiàn),如果反應(yīng)Ⅰ不發(fā)生積炭過程,則反應(yīng)Ⅱ也不會(huì)發(fā)生積炭過程。因此,若保持催化劑的活性,應(yīng)采取的條件是反應(yīng) Ⅰ Ⅱ CH4(g) C(s)+2H2(g)積炭消炭2CO(g) C(s)+CO2(g)積炭消炭△H(kJ?mol-1) +75 -173 。
②如果Ⅰ、Ⅱ均發(fā)生了積炭反應(yīng),通入過量水蒸氣能有效清除積炭,反應(yīng)的化學(xué)方程式是。組卷:37引用:3難度:0.6 -
27.實(shí)驗(yàn)小組探究(NH4)2S2O8溶液與KI溶液的反應(yīng)及其速率,實(shí)驗(yàn)操作和現(xiàn)象如下。
已知:i.(NH4)2S2O8具有強(qiáng)氧化性,能完全電離,S2易被還原為O2-8;SO2-4
ii.淀粉檢測(cè)I2的靈敏度很高,遇低濃度的I2即可快速變藍(lán);
iii.I2可與S2發(fā)生反應(yīng):2S2O2-3+I2═S4O2-3+2I-。O2-6
(1)實(shí)驗(yàn)1-1的目的是編號(hào) 1-1 1-2 實(shí)驗(yàn)操作 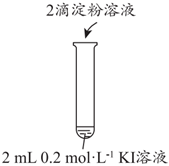
現(xiàn)象 無明顯現(xiàn)象 溶液立即變藍(lán) 。
(2)(NH4)2S2O8與KI反應(yīng)的離子方程式為。
為了研究(NH4)2S2O8與KI反應(yīng)的速率,小組同學(xué)分別向兩支試管中依次加入下列試劑,并記錄變色時(shí)間,如下表。
(3)加入Na2S2O3溶液后溶液變藍(lán)的時(shí)間明顯增長(zhǎng),甲同學(xué)對(duì)此提出猜想:編號(hào) 0.2mol/LKI溶液/mL 0.01mol?L-1Na2S2O3溶液/mL 蒸餾水/mL 0.4%的淀
粉溶液/滴0.2mol?L-1(NH4)2S2O8溶液/mL 變色時(shí)間/s 2-1 2 0 2.8 2 0.2 立即 2-2 2 0.8 0.2 2 2 30
猜想1:(NH4)2S2O8先與Na2S2O3反應(yīng),使c(S2)降低;O2-8
猜想2:(NH4)2S2O8先與KI反應(yīng),。
①甲同學(xué)提出猜想1的依據(jù):由信息iii推測(cè),Na2S2O3的還原性(填“強(qiáng)于”或“弱于”)KI的。
②乙同學(xué)根據(jù)現(xiàn)有數(shù)據(jù)證明猜想1不成立,理由是。
③補(bǔ)全猜想2。
(4)查閱文獻(xiàn)表明猜想2成立。根據(jù)實(shí)驗(yàn)2-2的數(shù)據(jù),計(jì)算30s內(nèi)的平均反應(yīng)速率v(S2)═O2-8mol?L-1?s-1(寫出計(jì)算式即可)。
(5)實(shí)驗(yàn)2-2中,30s內(nèi)未檢測(cè)到(NH4)2S2O8與Na2S2O3反應(yīng),可能的原因是。組卷:32引用:1難度:0.6


