2021-2022學(xué)年河南省開封市五縣高二(上)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共有15個小題,共39分,每題只有一個選項(xiàng)正確,1~6每題2分,7~15每題3分)
-
1.最新報(bào)道:科學(xué)家首次用X射線激光技術(shù)觀察到CO與O在催化劑表面形成化學(xué)鍵的過程。反應(yīng)過程的示意圖如下:下列說法正確的是( )
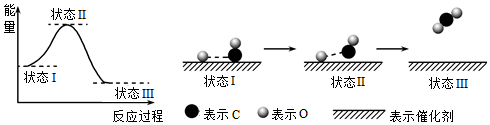
A.CO和O生成CO2是吸熱反應(yīng) B.在該過程中,CO斷鍵形成C和O C.CO和O生成了具有極性共價(jià)鍵的CO2 D.狀態(tài)Ⅰ→狀態(tài)Ⅲ表示CO與O2反應(yīng)的過程 組卷:545引用:88難度:0.7 -
2.關(guān)于強(qiáng)弱電解質(zhì)及非電解質(zhì)的組合完全正確的是( )
選項(xiàng) A B C D 強(qiáng)電解質(zhì) NaCl H2SO4 CaCO3 HNO3 弱電解質(zhì) HF BaSO4 HClO CH3COOH 非電解質(zhì) Cl2 CS2 蔗糖 H2CO3 A.A B.B C.C D.D 組卷:158引用:4難度:0.6 -
3.下列說法中正確的是( )
A.堿性鋅錳電池是二次電池 B.二次電池又叫蓄電池,它放電后可以再充電使活性物質(zhì)獲得再生 C.鉛酸蓄電池是一次電池 D.燃料電池的活性物質(zhì)儲存在電池內(nèi) 組卷:11引用:2難度:0.6 -
4.反應(yīng)2A(s)+B(g)?2C(g)+D(g)經(jīng)2min后B的濃度減少0.6mol?L-1。下列有關(guān)說法正確的是( )
A.用A表示的反應(yīng)速率是0.6mol?L-1?min-1 B.若分別用B、C、D表示反應(yīng)的速率,則其比是1:2:1 C.2min末時(shí)的反應(yīng)速率用反應(yīng)物B來表示是0.3mol?L-1?min-1 D.在2min內(nèi)用B和C表示的反應(yīng)速率的值是相同的 組卷:29引用:7難度:0.7 -
5.關(guān)于化學(xué)平衡常數(shù)的敘述正確的是( )
A.增大反應(yīng)物濃度,平衡常數(shù)隨之增大 B.兩種物質(zhì)反應(yīng),化學(xué)方程式的書寫方式不同,平衡常數(shù)不變 C.溫度一定時(shí),對于給定的化學(xué)反應(yīng),正、逆反應(yīng)的平衡常數(shù)互為倒數(shù) D.濃度商Q<K,v正<v逆 組卷:121引用:2難度:0.5 -
6.下列根據(jù)反應(yīng)原理設(shè)計(jì)的應(yīng)用,不正確的是( )
A. +H2O?CO2-3+OH-;用熱的純堿溶液清洗油污HCO-3B.Al3++3H2O?Al(OH)3(膠體)+3H+;明礬凈水 C.TiCl4+(x+2)H2O(過量)?TiO2?xH2O↓+4HCl;制備TiO2納米粉 D.SnCl2+H2O?Sn(OH)Cl↓+HCl;配制氯化亞錫溶液時(shí)加入氫氧化鈉 組卷:128引用:9難度:0.9
二、非選擇題:本題共5小題,共61分。
-
19.在室溫下,下列六種溶液:
①0.1mol/LNH4Cl;②0.1mol/LCH3COONH4;③0.1mol/LNH4HSO4;④pH=12的NH3?H2O和pH=2HCl等體積混合液;⑤0.1mol/LNH3?H2O;⑥0.1mol/L(NH4)2CO3
請根據(jù)要求填寫下列空白:
(1)溶液①、③呈酸性的原因不同,分別用方程式解釋。
(2)室溫下,測得溶液②的pH=7,則CH3COO-與NH4+濃度的大小關(guān)系是:c(CH3COO-)c(NH4+)(填“>”,“<”或“=”)。
(3)比較溶液①、②、③、⑤中c(NH4+)的大小關(guān)系。
(4)寫出溶液④中離子濃度的大小關(guān)系。
(5)寫出溶液⑥的電荷守恒。組卷:16引用:1難度:0.7 -
20.如圖1所示,某同學(xué)設(shè)計(jì)了一個燃料電池并探究氯堿工業(yè)原理和粗銅的精煉原理,其中乙裝置中X為陽離子交換膜。請按要求回答相關(guān)問題:

(1)甲烷燃料電池負(fù)極電極反應(yīng)式是:;
(2)石墨電極(C)的電極反應(yīng)式為;
(3)若在標(biāo)準(zhǔn)狀況下,有2.24L氧氣參加反應(yīng),則乙裝置中鐵電極上生成的氣體體積為L;丙裝置中陰極析出銅的質(zhì)量為g;
(4)某同學(xué)利甲烷燃料電池設(shè)計(jì)電解法制取漂白液或Fe(OH)2的實(shí)驗(yàn)裝置(如圖2所示)。
若用于制漂白液時(shí)a為電池極,電解質(zhì)溶液最好用。
若用于制Fe(OH)2,使用硫酸鈉做電解質(zhì)溶液,陽極選用作電極。組卷:158引用:6難度:0.5


