2020-2021學年北京市海淀區高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.如圖發電廠(站)的電能由化學能直接轉化而成的是( )
A. 
燃料電池發電站B. 
地熱發電廠C. 
風力發電廠D. 
水力發電站組卷:33引用:2難度:0.7 -
2.化學與生活息息相關,下列說法不正確的是( )
A.淀粉屬于多糖 B.天然藥物無毒副作用,可以長期服用 C.與銅質水龍頭連接處的鐵質水管更易被腐蝕 D.醫療垃圾有多種致病微生物,可用高溫焚燒處理 組卷:20引用:3難度:0.6 -
3.下列化學用語正確的是( )
A.中子數為18的氯原子: Cl1817B.CO2分子的電子式: 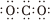
C.順-2-丁烯的結構簡式: 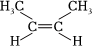
D.鋁離子的結構示意圖 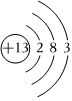 組卷:28引用:2難度:0.8
組卷:28引用:2難度:0.8 -
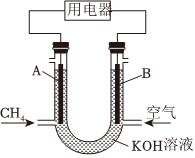 4.甲烷燃料電池的工作原理如圖,下列說法正確的是( )
4.甲烷燃料電池的工作原理如圖,下列說法正確的是( )A.A極為正極 B.K+從A極經溶液流向B極 C.工作一段時間后,B極附近的pH會減小 D.A極的電極反應為CH4+6OH--8e-═CO32-+5H2O 組卷:346引用:8難度:0.7 -
5.下列化學用語對事實的表述不正確的是( )
A.工業上用乙醛催化氧化法制乙酸:2CH3CHO+O2 2CH3COOH催化劑B.向AgNO3溶液中加入過量氨水:Ag++NH3?H2O ═AgOH↓+NH4+ C.用Na2S除去工業廢水中的Hg2+:Hg2++S2-═HgS↓ D.電鍍銅的陰極反應:Cu2++2e-═Cu 組卷:126引用:1難度:0.7 -
6.2Na2S2O3+I2═ 2NaI+Na2S4O6是定量分析中的常用反應。下列關于說法不正確的是( )
A.反應中,I2表現了氧化性 B.反應中,每生成1mol Na2S4O6,有4mol e-發生轉移 C.Na2S2O3是含有共價鍵的離子化合物 D.Na2S2O3在空氣中放置會變質,產物可能有Na2SO4 組卷:43引用:4難度:0.8
三、解答題(共2小題,滿分25分)
-
18.聚合硫酸鐵(PFS)是一種性能優異的無機高分子絮凝劑,其化學式通常表示為[Fe2(OH)2a(SO4)3-a]b。某化工廠制備PFS并用其處理廢水。
Ⅰ.用硫酸銅廢液制備PFS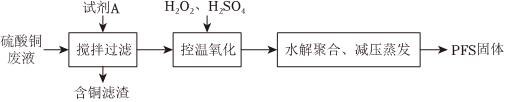
(1)試劑A為。
(2)“控溫氧化”發生反應的離子方程式為。
(3)測定PFS樣品中的n(OH-):取ag樣品,溶解于V1mLc1mol/L HCl溶液中,用KF溶液掩蔽Fe3+(使Fe3+不能與OH-反應),滴入酚酞溶液,再用c2mol/L NaOH溶液滴定,到達滴定終點時消耗NaOH溶液體積為V2mL。ag PFS樣品中的n(OH-)=mol。
Ⅱ.用石灰乳-PFS法處理含砷廢水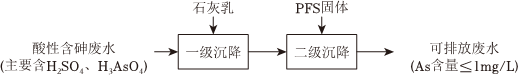
已知:
ⅰ.常溫下,Ca3(AsO4)2、CaHAsO4的Ksp均大于FeAsO4的Ksp,Fe2(HAsO4)3可溶;
ⅱ.常溫下,溶液中含砷微粒的物質的量分數與pH的關系如圖1。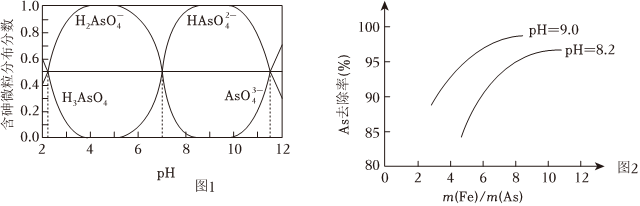
(4)下列說法不正確 的是。(填序號)
a.NaH2AsO4溶液的pH<7
b.pH=11.5時,c(H2)+2c(AsO-4)+3c(HAsO2-4)+c(OH-)=c(H+)AsO3-4
c.Na3AsO4溶液中,3c(Na+)=c()+c(AsO3-4)+c(H2AsO4)+c(H3AsO4)HAsO2-4
(5)“一級沉降”中,石灰乳的作用是。
(6)“二級沉降”中,溶液的pH在8~10之間,PFS形成的Fe(OH)3膠體粒子可以通過沉淀反應進一步減少溶液中的As含量,反應的離子方程式為。
(7)溶液的pH和m(Fe)/m(As)對As去除率的影響如圖2。某酸性含砷廢水中As含量為20mg/L,為達到排放標準(As含量≤1mg/L),從節約成本的角度考慮,工業上選擇的最佳條件是。(填序號)
a.pH=8.2m(Fe)/m(As)=5
b.pH=8.2m(Fe)/m(As)=8
c.pH=9.0m(Fe)/m(As)=5
d.pH=9.0m(Fe)/m(As)=8
[m(Fe)/m(As)指PFS中Fe元素質量與對應廢水中As元素質量之比]組卷:58引用:4難度:0.4 -
19.實驗小組探究酸對Fe3++3SCN-?Fe(SCN)3 平衡的影響。將0.005mol/L FeCl3溶液(接近無色)和0.01 mol/L KSCN溶液等體積混合,得到紅色溶液。取兩等份紅色溶液,進行如下操作并記錄現象。
(1)FeCl3水解顯酸性的原因是。(用離子方程式表示)
(2)甲同學認為加入酸后,會使Fe3++3SCN-?Fe(SCN)3體系中濃度改變,導致該平衡正向移動,溶液顏色加深。
【設計并實施實驗】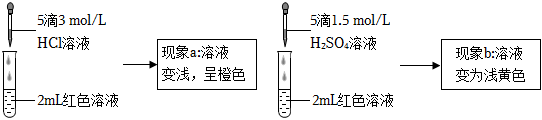
【查閱資料】
Fe3+和Cl-、均能發生絡合反應:SO2-4
Fe3++4Cl-?[FeCl4]-(黃色);Fe3++2?[Fe(SO4)2]-(無色)。SO2-4
實驗Ⅰ.探究現象a中溶液顏色變化的原因如表1:
表1:
(3)實驗①的目的是編號 操作 現象 ① 向2mL紅色溶液中滴加5滴水 溶液顏色無明顯變化 ② 向2mL紅色溶液中滴加5滴3mol/L KCl溶液 溶液顏色變淺,呈橙色 。
(4)根據實驗①和實驗②的結果,從平衡移動角度解釋現象a:。
實驗Ⅱ.探究現象b中溶液呈淺黃色的原因如表2
表2:
(5)結合實驗③可推測現象b中使溶液呈淺黃色的微粒可能有兩種,分別是編號 操作 現象 ③ 取1 mL 0.0025 mol/L Fe2(SO4)3溶液(無色),加入1mL 0.01 mol/L KSCN溶液,再加入5滴1.5 mol/L H2SO4溶液 溶液先變紅,加硫酸后變為淺黃色 ④ 取1 mL 0.005 mol/L FeCl3溶液, 。
(6)乙同學進一步補充了實驗④,確證了現象b中使溶液呈淺黃色的微粒只是(5)中的一種,請將實驗④的操作及現象補充完整:。組卷:118引用:6難度:0.7


