2011-2012學年湖南省長沙市長郡中學高二(上)化學家庭作業(1)(化學平衡)
發布:2024/4/20 14:35:0
一、選擇題、每小題只有一個正確答案
-
1.下列說法正確的是( )
A.活化分子碰撞即發生化學反應 B.升高溫度會加快反應速率,原因是增加了活化分子的碰撞次數 C.某一反應的活化分子百分數是個定值 D.活化分子的碰撞不一定是有效碰撞 組卷:58引用:9難度:0.9 -
2.對于反應N2+O2?2NO,在密閉容器中進行,下列條件中能使該反應的逆反應速率加快的是( )
A.縮小體積使壓強增大 B.壓強不變充入He使體積增大 C.體積不變充入He使壓強增大 D.壓強不變充入N2使體積增大 組卷:30引用:5難度:0.9 -
3.一定溫度下,在固定體積的密閉容器中發生下列反應:2HI(g)?H2(g)+I2(g).若c(HI)由0.1mol/L 降到0.07mol/L時,需要15s,那么c(HI)由0.07mol/L 降到0.05mol/L時,所需反應的時間為( )
A.等于5 s B.等于10 s C.大于10 s D.小于10 s 組卷:212引用:32難度:0.7 -
4.可確認發生了化學平衡移動的是( )
A.化學反應速率發生了改變 B.有氣態物質參加的可逆反應達到平衡后,改變了壓強 C.由于某一條件的改變,使平衡混合物中各組分的濃度發生了不同程度的改變 D.可逆反應達到平衡后,使用催化劑 組卷:103引用:33難度:0.9 -
5.恒溫、恒壓下,a mol A和b mol B在一個容積可變的容器中發生如下反應:A(g)+2B(g)?2C(g),一段時間后達到平衡,生成n mol C.則下列說法中正確的是( )
A.物質A、B的轉化率之比為a:b B.當v正(A)=2v逆(B)時,可確定反應達到平衡 C.起始時刻和達到平衡后容器中的壓強比為(a+b):(a+b- )n2D.若起始時放入2a mol A和2b mol B,則達到平衡時生成2n mol C 組卷:23引用:4難度:0.7 -
6.如圖是恒溫下某化學反應的反應速率隨反應時間變化的示意圖.下列敘述與示意圖不相符合的是( )
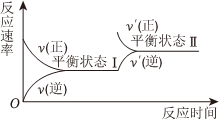
A.反應達平衡時,正反應速率和逆反應速率相等 B.該反應達到平衡狀態Ⅰ后,增大反應物濃度,平衡發生移動,達到平衡狀態Ⅱ C.該反應達到平衡狀態Ⅰ后,減小反應物濃度,平衡發生移動,達到平衡狀態Ⅱ D.同一種反應物在平衡狀態Ⅰ和平衡狀態Ⅱ時濃度不相等 組卷:438引用:47難度:0.7 -
7.將2mol A和1mol B充入某密閉容器中發生反應:2A(g)+B(g)?xC(g),達到化學平衡后,C的體積分數為a.假設該反應的條件分別和下列各選項的條件相同,下列判斷正確的是( )
A.若在恒溫恒壓下,當x=1時按1.5 mol A、1 mol C作為起始物質,平衡后C的體積分數仍為a B.若在恒溫恒容下,當x=2時將2 mol C作起始物質,平衡后C的體積分數仍為a C.若在恒溫恒壓下,當x=3時1 mol A、1 mol B、6 mol C作起始物質,平衡后C的體積分數仍為a D.若在恒溫恒容下,按0.6 mol A、0.3 mol B、1.4 mol C作起始物質,平衡后C的體積分數仍為a,則x只能等于2 組卷:66引用:3難度:0.7 -
8.在一定溫度下,某容積不變的密閉容器中建立下列化學平衡C(s)+H2O(g)?CO(g)+H2(g),下列敘述中不能認定上述可逆反應在一定條件下已達到化學平衡狀態的是( )
A.體系的壓強不再發生變化 B.v正(CO)=v逆(H2O) C.生成n mol CO的同時生成n mol H2 D.1mol H-H鍵斷裂的同時2mol H-O鍵斷裂 組卷:152引用:31難度:0.7 -
9.已知下列反應的平衡常數:①H2(g)+S(s)?H2S(g)K1 ②S(s)+O2(g)?SO2(g) K2則相同溫度下,反應H2+SO2?O2+H2S的平衡常數為( )
A.K1+K2 B.K1-K2 C.K1×K2 D. K1K2組卷:169引用:8難度:0.7 -
10.在體積可變的密閉容器中,反應mA(g)+nB(s)?pC(g)達到平衡后,壓縮容器的體積,發現A的轉化率隨之降低.下列說法中,正確的是( )
A.m+n必定小于p B.m+n必定大于p C.m必定小于p D.m必定大于p 組卷:138引用:30難度:0.9 -
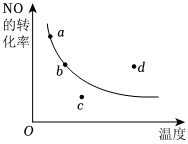 11.如圖所示為條件一定時,反應2NO(g)+O2(g)?2NO2(g) (正反應為放
11.如圖所示為條件一定時,反應2NO(g)+O2(g)?2NO2(g) (正反應為放
熱)中NO的轉化率與溫度變化關系曲線圖,圖中有a、b、c、d四個點,其中表示未達到平衡狀態,且v正<v逆的點是( )A.a B.b C.c D.d 組卷:35引用:1難度:0.9 -
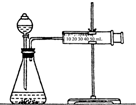 12.右圖所示是用稀硫酸與鋅反應測定反應速率的裝置,在分液漏斗中加入稀硫酸,在錐形瓶中加入鋅,通過測定產生一定量氣體所用的時間來測定反應的速率.現用50mL 1mol/L硫酸,在錐形瓶中加入下列各種鋅(總質量相同),產生H2最快的是( )
12.右圖所示是用稀硫酸與鋅反應測定反應速率的裝置,在分液漏斗中加入稀硫酸,在錐形瓶中加入鋅,通過測定產生一定量氣體所用的時間來測定反應的速率.現用50mL 1mol/L硫酸,在錐形瓶中加入下列各種鋅(總質量相同),產生H2最快的是( )A.純的鋅粒 B.純的鋅粉 C.含少量銅雜質的鋅粒 D.含少量銅雜質的鋅粉 組卷:21引用:1難度:0.7 -
13.反應2A(g)+B(g)?xC(g)+2D(s),在一定條件下的2L容器中,1mol A與0.5mol B反應達到平衡時A為0.3mol/L,在1L容器中1mol A與0.5mol B在相同溫度下反應達到平衡時A為0.5mol/L,則x值最合適為( )
A.2 B.1 C.大于2 D.小于3 組卷:34引用:7難度:0.7
二、非選擇題:
-
39.在一固定容積的密閉容器中,進行如下化學反應:
CO2(g)+H2(g)?CO(g)+H2O(g)△H=Q kJ?mol-1
其化學平衡常數K和溫度T的關系如下表:
請回答:T/℃ 700 800 850 1 000 1 200 K 0.6 0.9 1.0 1.7 2.6
(1)上述反應中Q0(選填“>”或“<”);
(2)判斷該反應已達到化學平衡狀態的依據是.
a.容器中壓強不變 b.反應熱△H不變 c.v正(H2)=v逆(CO) d.CO2的質量分數不變
(3)溫度為t℃時,可逆反應CO2(g)+H2(g)?CO(g)+H2O(g)在固定容積的密閉容器中進行,容器內各物質的濃度變化如下表:
①該反應的反應溫度t時間/min CO2 H2 CO H2O 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 0.100 0.200 0.100 0.100 4 0.100 0.200 0.100 0.100 5 0.116 0.216 0.084 6 0.096 0.266 0.104 (填“大于”“小于”或“等于”)850℃,判斷依據是.
②反應在4~5min之間,平衡(填“向左”“向右”或“不”)移動,可能的原因是.
a.增加CO的濃度 b.加壓 c.使用催化劑 d.增加水蒸氣濃度
③t℃時,表中5~6min之間數值發生變化,可能的原因是.
a.增加H2O的濃度 b.加壓 c.增加氫氣濃度 d.使用催化劑.組卷:25引用:2難度:0.5 -
 40.一定溫度下,在容積固定的V L密閉容器里加入n mol A、2n mol B,發生反應:A(g)+2B(g) 2C(g)△H<0,反應達平衡后測得平衡常數為K,此時A的轉化率為x.加熱
40.一定溫度下,在容積固定的V L密閉容器里加入n mol A、2n mol B,發生反應:A(g)+2B(g) 2C(g)△H<0,反應達平衡后測得平衡常數為K,此時A的轉化率為x.加熱
(1)K和x的關系滿足K=.在保證A濃度不變的情況下,增大容器的體積,平衡(填字母).
A.向正反應方向移動 B.向逆反應方向移動 C.不移動
(2)若該反應的逆反應速率與時間的關系如圖所示:
①可見反應在t1、t3、t7時都達到了平衡,而t2、t8時都改變了一種條件,試判斷改變的是什么條件:
t2時;
t8時;
②t2時平衡向(填“正反應”或“逆反應”)方向移動;
③若t4時降壓,t5時達到平衡,t6時增大反應物的濃度,請在圖中畫出t4~t6時逆反應速率與時間的關系線.組卷:130引用:4難度:0.1


