2023年北京市門頭溝區(qū)高考化學(xué)一模試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.北京冬奧會成功舉辦、“天宮課堂”授課、神舟十五號載人飛船發(fā)射成功及“C919”飛機(jī)等,均展示了我國科技發(fā)展的巨大成就。下列相關(guān)敘述正確的是( )
A.冬奧會“飛揚”火炬所用的燃料H2為氧化性氣體 B.乙酸鈉過飽和溶液析出結(jié)晶水合物屬于化學(xué)變化 C.載人飛船采用了太陽能剛性電池陣,將化學(xué)能轉(zhuǎn)化為電能供飛船使用 D.“C919”飛機(jī)機(jī)身使用的材料碳纖維屬于新型無機(jī)非金屬材料 組卷:61引用:3難度:0.8 -
2.下列化學(xué)用語或圖示表達(dá)不正確的是( )
A.氯化鈣的電子式: 
B.基態(tài)C原子的軌道表示式: 
C.順-2-丁烯的分子結(jié)構(gòu)模型: 
D.Cl-Cl的p-pσ鍵電子云圖形:  組卷:53引用:1難度:0.6
組卷:53引用:1難度:0.6 -
3.我國發(fā)布了《醫(yī)用同位素中長期發(fā)展規(guī)劃(2021-2035年)》,對提升醫(yī)用同位素相關(guān)產(chǎn)業(yè)能力水平、保障健康中國戰(zhàn)略實施具有重要意義。醫(yī)用同位素有14C、18F、131I、60Co等,有關(guān)說法不正確的是( )
A.60Co位于元素周期表的第四周期第Ⅷ族 B.18F和131I的最外層電子數(shù)相同 C.14C與12C的化學(xué)性質(zhì)幾乎相同 D.化合物23Na18F的中子總數(shù)為41 組卷:103引用:2難度:0.7 -
4.下列方程式與所提供的事實不相符的是( )
A.向氯水中通入SO2,溶液褪色:SO2+Cl2+2H2O═2HCl+H2SO4 B.向NaHCO3溶液中滴入少量酚酞溶液,溶液變?yōu)闇\紅色: ?HCO-3+H+CO2-3C.實驗室制取氨氣:2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O△D.少量鐵粉與稀硝酸反應(yīng):Fe+4H++ ═Fe3++NO↑+2H2ONO-3組卷:73引用:1難度:0.5 -
5.下圖所示的實驗,不能達(dá)到實驗?zāi)康牡氖牵ā 。?br />
A B C D 



比較Fe3+的催化效果好于Cu2+ 用溴水檢驗CH3CH2Br與NaOH乙醇溶液生成的乙烯 驗證鐵發(fā)生吸氧腐蝕 實驗室制Cl2時,除去Cl2中的HCl并干燥 A.A B.B C.C D.D 組卷:74引用:3難度:0.5 -
6.2022年諾貝爾化學(xué)獎授予了對點擊化學(xué)和生物正交化學(xué)做出貢獻(xiàn)的科學(xué)家。點擊化學(xué)的代表反應(yīng)為銅([Cu])催化的疊氮-炔基Husigen成環(huán)反應(yīng),其原理如圖。

下列說法不正確的是( )A.上述循環(huán)中H+是中間產(chǎn)物之一 B.上述循環(huán)過程中只有極性鍵的斷裂和形成 C.Cu能降低反應(yīng)的活化能,但不改變總反應(yīng)的焓變 D.中間產(chǎn)物  中N采取sp2、sp3雜化組卷:44引用:1難度:0.6
中N采取sp2、sp3雜化組卷:44引用:1難度:0.6
二、解答題(共5小題,滿分58分)
-
 18.為回收利用廢釩催化劑(含有V2O5、VOSO4及不溶性殘渣),科研人員研制了一種回收V2O5的新工藝,主要流程如圖。
18.為回收利用廢釩催化劑(含有V2O5、VOSO4及不溶性殘渣),科研人員研制了一種回收V2O5的新工藝,主要流程如圖。
已知:i.部分含釩物質(zhì)常溫下在水中的溶解性如下表所示:
ii.物質(zhì) VOSO4 V2O5 NH4VO3 (VO2)2SO4 溶解性 可溶 難溶 難溶 易溶 +2OH-?VO+2+H2O。VO-3
回答下列問題:
(1)用水浸泡廢釩催化劑,為了提高單位時間內(nèi)廢釩的浸出率,可以采取的措施為、(寫兩條)。
(2)濾液1和濾液2中含釩的主要物質(zhì)成分相同。在濾渣1中加入Na2SO3和過量H2SO4溶液發(fā)生反應(yīng)的化學(xué)方程式為。
(3)生成的反應(yīng)中消耗1molKClO3時轉(zhuǎn)移6mol電子,該反應(yīng)的離子方程式為VO+2。
(4)結(jié)合化學(xué)用語,用平衡移動原理解釋加入氨水的作用為。
(5)最后釩以NH4VO3的形式沉淀出來。以沉釩率(NH4VO3沉淀中V的質(zhì)量和廢催化劑中V的質(zhì)量之比)表示該步反應(yīng)釩的回收率。請解釋如圖溫度超過80℃以后,沉釩率下降的可能原因是(寫兩條)。
(6)測定產(chǎn)品中V2O5的純度稱取ag產(chǎn)品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入b1mLc1mol?L-1H2C2O4溶液(2+H2C2O4+2H+═2VO2++2CO2↑+2H2O),最后用c2mol?L-1KMnO4溶液滴定過量的H2C2O4至終點,消耗KMnO4溶液的體積為b2mL。已知VO+2被還原為Mn2+,假設(shè)雜質(zhì)不參與反應(yīng)。則產(chǎn)品中V2O5(摩爾質(zhì)量:182g?mol-1)的質(zhì)量分?jǐn)?shù)是MnO-4(列出計算式)。組卷:110引用:2難度:0.3 -
19.某小組同學(xué)探究
、MnO-4的性質(zhì)。MnO2-4
資料:i.的氧化能力與溶液的酸堿度有關(guān),在酸性環(huán)境、中性環(huán)境、堿性環(huán)境能被MnO-4分別還原為Mn2+(無色)、MnO2、SO2-3(綠色)。MnO2-4
ii.在強(qiáng)堿溶液中能穩(wěn)定存在,在酸性或純水環(huán)境中易轉(zhuǎn)化為MnO2-4和MnO2。MnO-4
Ⅰ.驗證與MnO-4的反應(yīng),實驗如下:SO2-3
(1)實驗①參與反應(yīng)的高錳酸鉀和亞硫酸鈉物質(zhì)的量之比為實驗 序號 試劑X 現(xiàn)象 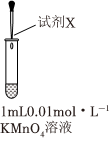
① 2滴3mol?L-1H2SO4
3滴0.1mol?L-1Na2SO3溶液褪為無色 ② 2滴純水
3滴0.1mol?L-1Na2SO3產(chǎn)生棕色沉淀 ③ 2滴6mol?L-1NaOH
3滴0.1mol?L-1Na2SO3溶液變?yōu)榫G色 ④ 2滴6mol?L-1NaOH
10滴0.1mol?L-1Na2SO3溶液變?yōu)榫G色溶液,有渾濁,綠色很快消失,有大量棕色沉淀生成 。
(2)實驗④中綠色很快消失,有大量棕色沉淀生成,結(jié)合離子方程式分析可能的原因。甲同學(xué)補(bǔ)做了實驗(填操作和現(xiàn)象),證明猜測合理。
Ⅱ.驗證的性質(zhì)。MnO2-4
某同學(xué)用b試管得到的綠色溶液設(shè)計實驗如圖: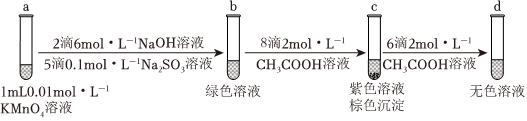
(3)c試管中得到紫色溶液和棕色渾濁的離子反應(yīng)方程式為。繼續(xù)滴加醋酸,沉淀溶解,得到無色透明溶液,有如下兩種猜想:
①、MnO2可能被CH3COOH還原。MnO-4
設(shè)計實驗:將1mL0.01mol?L-1KMnO4溶液與少量MnO2固體混合,再向其中加入少許2mol?L-1CH3COOH溶液,(填現(xiàn)象),證明猜想不合理。
②、MnO2可能被MnO-4還原,發(fā)生的反應(yīng):,。
經(jīng)實驗驗證,猜想合理。
由以上實驗可知:、MnO2的性質(zhì)不僅與溶液的酸堿度有關(guān);還與試劑的用量等有關(guān)。SO2-3組卷:132引用:1難度:0.3


