2023-2024學年陜西省西安市藍田縣部分學校聯考高二(上)期中化學試卷
發布:2024/10/10 0:0:4
一、選擇題。共16小題,每小題3分,共48分。在每小題給出的四個選項中,只有一項是符合要求的。
-
1.下列說法不正確的是( )
A.2014年德美科學家因開發超分辨率熒光顯微鏡獲諾貝爾化學獎,使光學顯微鏡分辨率步入了納米時代.利用此類光學顯微鏡可以觀察活細胞內蛋白質等大分子 B.利用外接直流電源保護鐵質建筑物,屬于電化學中犧牲陽極的陰極保護法 C.鑭鎳合金能大量吸收H2形成金屬氫化物,可作儲氫材料 D.分類方法、統計方法、定量研究、實驗方法和模型化方法等是化學研究的常用方法 組卷:183引用:4難度:0.9 -
2.用石墨作電極電解0.1mol?L-1的NaCl溶液,通電一段時間后發現,相同條件下兩極收集的氣體體積之比為4:3,下列說法正確的是( )
A.陽極產生的氣體的平均摩爾質量為58g?mol-1 B.陽極產生氣體的物質的量是陰極產生氣體的物質的量的 34C.在電解后的溶液中注入一定量的稀鹽酸可以使溶液恢復到電解前狀態 D.在電解后的溶液中通入標準狀況下的氯化氫氣體4.48L,并注入0.2mol水可以使溶液恢復到電解前狀態 組卷:14引用:1難度:0.7 -
3.如圖是2SO3(g)?2SO2(g)+O2(g) 的能量變化圖,據圖得出的相關敘述正確的是( )

A.2SO3(g)?2SO2(g)+O2(g)+(a-b) kJ B.1mol SO2的能量比1mol SO3的能量高 C.若有2mol SO3充分反應,吸收(a-b) kJ熱量 D.該化學反應過程中的能量變化既有吸熱又有放熱 組卷:40引用:2難度:0.6 -
4.白磷、紅磷是磷的兩種同素異形體,它們的結構如圖所示。某溫度下1mol白磷轉化為紅磷時放出29.2kJ的熱量,下列敘述正確的是( )

A.白磷轉化為紅磷是物理變化 B.白磷比紅磷的能量低 C.白磷比紅磷穩定 D.紅磷轉化為白磷是吸熱反應 組卷:51引用:3難度:0.5 -
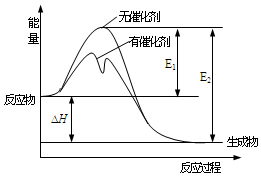 5.2SO2(g)+O2(g)?2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述正確的是( )
5.2SO2(g)+O2(g)?2SO3(g)反應過程中的能量變化如圖所示(圖中E1表示無催化劑時正反應的活化能,E2表示無催化劑時逆反應的活化能)。下列有關敘述正確的是( )A.該反應的逆反應為吸熱反應,SO2的能量一定高于SO3的能量 B.500℃、101kPa下,將1molSO2(g)和0.5molO2(g)置于密閉容器中充分反應生成SO3(g)放熱akJ,其熱化學方程式為2SO2+O2(g)?2SO3(g)ΔH═-2akJ?mol-1 C.該反應中,反應物的總鍵能小于生成物的總鍵能 D.ΔH═E2-E1,使用催化劑改變活化能,但不改變反應熱 組卷:44引用:3難度:0.6 -
6.為了探究溫度、硫酸銅對鋅與稀硫酸反應速率的影響規律,某同學設計如下方案:
下列推斷合理的是( )編號 純鋅粉質量 0.2mol?L-1硫酸體積 溫度 硫酸銅固體質量 Ⅰ 2.0g 10.0mL 25℃ 0 Ⅱ 2.0g 10.0mL t℃ 0 Ⅲ 2.0g 10.0mL 35℃ 0.2g Ⅳ 2.0g 10.0mL 35℃ 4.0g A.為了選擇Ⅱ和Ⅲ實驗探究硫酸銅對反應速率的影響,必須控制t=25 B.待測物理量是收集等體積(相同條件)氣體所需要的時間,時間越長,反應越快 C.根據該方案,還可以探究硫酸濃度對反應速率的影響 D.根據該實驗方案得出反應速率大小可能是Ⅲ>Ⅱ>Ⅰ>Ⅳ 組卷:63引用:6難度:0.7
二、非選擇題。共4大題52分。請考生將答案寫在答題卡相應位置。
-
19.硫酸鐵銨[Fe2(SO4)3?2(NH4)2SO4?nH2O]是一種凈水劑,廣泛用于城鎮生活飲用水、工業循環水的凈化處理等,可用硫酸亞鐵(含少量硝酸鈣)和硫酸銨為原料,按如下工藝流程制取.

(1)步驟1中用H2SO4酸化的目的是.
(2)下列關于此制備流程的說法正確的是.
A.步驟Ⅰ要進行抽濾時,用傾析法先轉移溶液,要待溶液完全流盡時才能再轉移沉淀
B.宜用一定體積分數的乙醇溶液洗滌產品
C.為了后面步驟Ⅳ更好的過濾分離,操作B宜用冰水浴快速冷卻結晶
D.操作C為常溫干燥或高溫干燥
(3)上述步驟Ⅱ中氧化后,蒸發前需取少量氧化產物檢驗Fe2+是否全部被氧化,能否用酸性K.MnO4溶液檢驗?為什么?.
(4)某研究小組為探究產品硫酸鐵銨中N元素的質量分數,采用了以下方法:取1.40g產品,加入足量NaOH溶液,加熱,使產生的NH3全部被20.00mL 0.50mol/L H2SO4溶液(足量)吸收,然后再用一定濃度的標準溶液滴定反應后的溶液.此過程中要用到滴定管,選出其正確操作并按序列出字母:檢查滴定管是否漏水→蒸餾水洗滌→→→→→→滴定管準備完成.
a.從滴定管上口加入高于“0”刻度3mL所要盛裝的溶液
b.從滴定管上口加入3mL所要盛裝的溶液,傾斜著轉動滴定管
c.將洗滌液從滴定管上口倒入預置的燒杯中
d.將洗滌液從滴定管下部放入預置的燒杯中
e.調整液面至“0”刻度或“0”刻度以下,記錄數據
f.輕輕轉動活塞使滴定管的尖嘴部分充滿溶液,無氣泡
g.輕輕擠壓玻璃球使滴定管的尖嘴部分充滿溶液,無氣泡
本實驗中宜選用的常用指示劑為.經測定N元素的質量分數為10%,以下可選用的標準液中最好的是.
A.0.50mol/L NaOH溶液
B.2.0mol/L NaOH溶液
C.1.0mol/L氨水組卷:21引用:2難度:0.5 -
 20.在一容積為2L的密閉容器中,加入0.2mol的N2和0.6mol的H2,在一定條件下發生如下反應:N2(g)+3H2(g)?2NH3(g)ΔH<0反應中NH3的物質的量濃度的變化情況如圖所示,請回答下列問題:
20.在一容積為2L的密閉容器中,加入0.2mol的N2和0.6mol的H2,在一定條件下發生如下反應:N2(g)+3H2(g)?2NH3(g)ΔH<0反應中NH3的物質的量濃度的變化情況如圖所示,請回答下列問題:
(1)根據如圖,計算從反應開始到平衡時,平衡反應速率v(NH3)為mol/(L?min).
(2)該反應達到平衡時H2的轉化率.
(3)反應達到平衡后,第5分鐘末,保持其它條件不變,若改變反應溫度,則NH3的物質的量濃度不可能為.(填序號)
a.0.20mol?L-1 b.0.12mol?L-1 c.0.10mol?L-1 d.0.08mol?L-1
(4)反應達到平衡后,第5分鐘末,保持其它條件不變,若只把容器的體積縮小一半,平衡移動(填“向逆反應方向”、“向正反應方向”或“不”).
(5)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達到新的平衡(此時NH3的濃度約為0.25mol?L-1),請在圖中畫出第5分鐘末到此平衡時NH3濃度的變化曲線.組卷:12引用:4難度:0.5


