2021-2022學年湖南師大附中高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列熱化學方程式或敘述正確的是( )
A.1 mol液態肼在足量氧氣中完全燃燒生成水蒸氣,放出642kJ的熱量:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ?mol-1 B.12 g石墨轉化為CO時,放出110.5 kJ的熱量:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ?mol-1 C.已知:H2(g)+ O2(g)═H2O(l)△H=-286 kJ?mol-1,則:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ?mol-112D.已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1,則在一定條件下向密閉容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反應放出46.2 kJ的熱量 組卷:40引用:7難度:0.7 -
2.下列說法正確的是( )
A.ΔH的大小與熱化學方程式的化學計量數無關 B.等量的硫蒸氣和固態硫分別完全燃燒,前者放出的熱量多 C.由C(s,石墨)=C(s,金剛石)ΔH=+1.9kJ/mol可知,金剛石比石墨穩定 D.在101kPa時,1mol氫氣燃燒所放出的熱量為氫氣的燃燒熱 組卷:76引用:3難度:0.9 -
3.反應C2H6(g)?C2H4(g)+H2(g)△H>0在一定條件下于密閉容器中達到平衡。下列各項措施中,不能提高乙烷平衡轉化率的是( )
A.增大容器容積 B.升高反應溫度 C.分離出部分氫氣 D.等容下通入惰性氣體 組卷:773引用:9難度:0.8 -
 4.在恒溫恒容條件下,發生反應A(s)+2B(g)?3X(g),c(B)隨時間的變化如圖中曲線甲所示。下列說法不正確的是( )
4.在恒溫恒容條件下,發生反應A(s)+2B(g)?3X(g),c(B)隨時間的變化如圖中曲線甲所示。下列說法不正確的是( )A.從a、c兩點坐標可求得從a到c時間間隔內該化學反應的平均速率 B.從b點切線的斜率可求得該化學反應在反應開始時的瞬時速率 C.在不同時刻都存在關系:2v(B)=3v(X) D.維持溫度、容積、反應物起始的量不變,向反應體系中加入催化劑,c(B)隨時間變化關系如圖中曲線乙所示 組卷:331引用:4難度:0.6 -
5.某硝酸廠處理尾氣中NO的方法是在催化劑存在下,用H2將NO還原為N2,其熱化學方程式為 NO(g)+H2(g)=
N2(g)+H2O(g) ΔH=mkJ?mol-1其能量變化過程如圖:12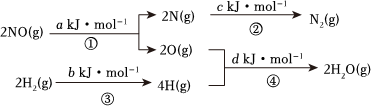
下列說法正確的是( )A.過程①②③④都是放熱過程 B.m=+ (a+b-c-d)kJ?mol-112C.m=- (c+a-d-b)kJ?mol-112D.m=+ (c+d-a-b)kJ?mol-112組卷:38引用:1難度:0.8 -
6.研究表明N2O與CO在Fe+作用下發生反應的能量變化及反應過程如圖所示,下列有關說法錯誤的是( )
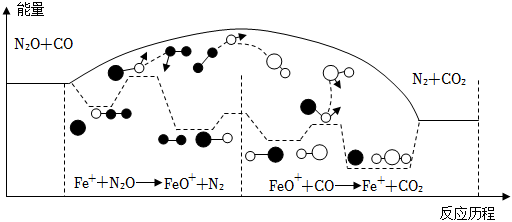
A.Fe+是該反應的催化劑 B.該反應中斷裂N2O 和CO中化學鍵吸收的能量大于形成N2和CO2中化學鍵釋放的能量 C.1molN2O完全反應轉移2mole- D.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2兩步反應均為放熱反應 組卷:60引用:2難度:0.7
三、非選擇題:本題共4小題,共54分。請考生根據要求作答。溫度計
-
17.(1)工業合成氨的反應為N2(g)+3H2(g)?2NH3(g)。設在容積為2.0L的密閉容器中充入0.6molN2(g)和1.60molH2(g),反應在一定條件下達到平衡時,NH3的物質的量分數(NH3的物質的量與反應體系中總的物質的量之比)為
,試計算:47
①該條件下H2平衡轉化率為,H2的物質的量分數為(小數點后保留一位)。
②該條件下N2的平衡轉化率(小數點后保留一位)。
③該條件下反應2NH3(g)?N2(g)+3H2(g)的平衡常數為。
(2)已知:H-H鍵的鍵能為436kJ?mol-1,H-N鍵的鍵能為391kJ?mol-1,N≡N鍵的鍵能為946kJ?mol-1,則N2與H2反應生成NH3的熱化學方程式為。
(3)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(l)ΔH=-xkJ/mol。蒸發1molH2O(1)需要吸收的能量為44kJ,其他相關數據如下表所示:
表中z的大小用x、a、b、d表示為NH3(g) O2(g) NO(g) H2O(g) 1mol分子中的化學鍵斷裂時需要吸收的能量/kJ a b z d 。
(4)常溫常壓下,1.5g火箭燃料二甲基肼(CH3-NH-NH-CH3)完全燃燒放出50kJ熱量,則二甲基肼的燃燒熱為。組卷:17引用:1難度:0.6 -
18.研究二氧化碳的資源化利用具有重要的意義。回答下列問題:
(1)已知下列熱化學方程式:
反應I:CO2(g)+4H2(g)?CH4(g)+2H2O(g)ΔH1=-164.9kJ/mol。
反應Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2=+41.2kJ/mol
則反應CH4(g)+H2O(g)?CO(g)+3H2(g)的ΔH3=。
(2)在T℃時,將CO2和H2加入容積不變的密閉容器中,發生反應CO2(g)+4H2(g)?CH4(g)+2H2O(g),能判斷反應達到平衡的是(填字母)。
A.CO2的消耗速率和CH4的生成速率相等
B.容器內氣體壓強不再發生變化
C.混合氣體的密度不再發生變化
D.混合氣體的平均相對分子質量不再發生變化
(3)將n(CO2):n(H2)=1:4的混合氣體充入密閉容器中發生上述反應Ⅰ、Ⅱ,在不同溫度和壓強時,CO2的平衡轉化率如圖所示。
0.1MPa時,CO2的轉化率在600℃之后隨溫度升高而增大的主要原因是。
(4)CO2加氫制備CH4的一種催化機理如圖,下列說法正確的是。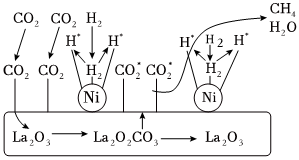
A.催化過程使用的催化劑為La2O3和La2O3CO3
B.La2O3CO3可以釋放出CO2*(活化分子)
C.H2經過Ni活性中心斷鍵裂解產生活化態H*的過程為放熱過程
D.CO2加氫制備CH4的過程需要La2O3和Ni共同完成
(5)一定溫度和壓強為1MPa條件下,將CO2和H2按物質的量之比為1:4通入密閉彈性容器中發生催化反應,假設只發生反應;
Ⅰ.CO2(g)+4H2(g)?CH4(g)+2H2O(g)
Ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)
10min時兩個反應均達到平衡,CO2平衡轉化率為80%.CH4選擇性為50%,[CH4的選擇性=]。該溫度下,反應Ⅱ的Kp=n(CH4)n(CH4)+n(CO)(已知Kp是用反應體系中氣體物質的分壓來表示的平衡常數,即將K表達式中平衡濃度用平衡分壓代替),用CH4的分壓變化表示反應Ⅰ在10分鐘內達平衡的平均速率為(保留兩位有效數字)MPa?min-1。組卷:13引用:1難度:0.7


