2022年安徽省部分名校高考化學模擬試卷
發布:2024/4/20 14:35:0
一、選擇題(共包括22個小題。每小題均只有一一個符合題意的選項)
-
1.下列實驗裝置正確的是( )
A. 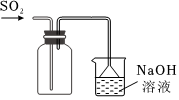
用圖所示裝置收集SO2氣體B. 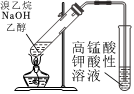
用圖所示裝置檢驗溴乙烷與NaOH醇溶液共熱產生的C2H4C. 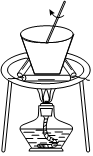
用圖所示裝置從食鹽水中提取NaClD. 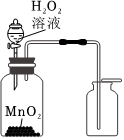
用圖所示裝置制取并收集O2組卷:18引用:1難度:0.7 -
2.如圖是實驗室研究海水對鐵閘不同部位腐蝕情況的剖面示意圖。下列說法錯誤的是( )
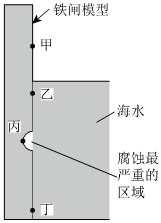
A.鐵閘主要發生的是吸氧腐蝕 B.圖中生成鐵銹最多的是乙區域 C.鐵腐蝕時的電極反應式:Fe-2e-═Fe2+ D.將鐵閘與石墨相連可保護鐵閘 組卷:113引用:2難度:0.8 -
3.下列實驗對應的現象及結論均正確且兩者具有因果關系的是( )
選項 實驗 現象 A 將SO2通入BaCl2溶液中,然后滴入HNO3 有白色沉淀生成,且白色沉淀不溶于稀硝酸 所得的沉淀為BaSO3,后轉化為BaSO4 B 向足量含有淀粉的FeI2溶液中滴加2滴氯水 溶液變藍 還原性:I->Fe2+ C 向FeCl2溶液中加入Na2O2粉末 出現紅褐色沉淀和無色液體 FeCl2溶液部分變質 D 將濃硫酸滴入蔗糖中并攪拌 得黑色蓬松的固體并有刺激性氣味 該過程中濃硫酸僅體現了吸水性和脫水性 A.A B.B C.C D.D 組卷:15引用:2難度:0.5 -
4.下列實驗能達到目的的是( )
A.用飽和碳酸氫鈉溶液鑒別SO2和CO2 B.用灼熱的銅網除去CO中少量的O2 C.用溴水鑒別苯和CCl4 D.用蒸發結晶的方法從碘水中提取碘單質 組卷:34引用:5難度:0.8 -
5.有關晶體的下列說法中正確的是( )
A.原子晶體中共價鍵越強,熔點越高 B.分子晶體中分子間作用力越大,分子越穩定 C.冰融化時水分子中共價鍵發生斷裂 D.CaCl2晶體中含有兩種化學鍵 組卷:210引用:3難度:0.9 -
6.下列儀器不能直接受熱的是( )
A. 
B. 
C. 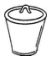
D. 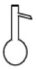 組卷:44引用:3難度:0.6
組卷:44引用:3難度:0.6 -
7.新型冠狀病毒是一種致病性很強的 RNA 病毒,下列說法錯誤的是( )
A.新型冠狀病毒組成元素中含有 C、H、O B.用“84 消毒液”進行消毒時,消毒液越濃越好 C.3M 防顆粒物口罩均使用 3M 專有高效過濾材料--聚丙烯材質,聚丙烯屬于高分子 D.不去人群聚集處、勤洗手可預防新型冠狀病毒 組卷:83引用:3難度:0.8 -
8.周期表中有如圖所示的元素,下列敘述正確的是( )

A.47.87是豐度最高的鈦原子的相對原子質量 B.鈦原子的M層上共有10個電子 C.從價電子構型看,鈦屬于某主族元素 D.22為鈦原子的質量數 組卷:110引用:3難度:0.7 -
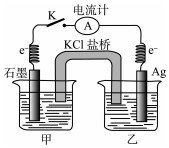 9.已知常溫下反應:Fe3++Ag?Fe2++Ag+的平衡常數K=0.3.現將含0.010 mol/LFe(NO3)2和0.10 mol/LFe(NO3)3的混合溶液倒入燒杯甲中,將含0.10 mol/L的AgNO3溶液倒入燒杯乙中(如圖),閉合開關K,關于該原電池的說法正確的是( )
9.已知常溫下反應:Fe3++Ag?Fe2++Ag+的平衡常數K=0.3.現將含0.010 mol/LFe(NO3)2和0.10 mol/LFe(NO3)3的混合溶液倒入燒杯甲中,將含0.10 mol/L的AgNO3溶液倒入燒杯乙中(如圖),閉合開關K,關于該原電池的說法正確的是( )A.原電池發生的總反應中Ag+氧化Fe2+ B.鹽橋中陽離子從左往右作定向移動 C.石墨為負極,電極反應為Fe2+-e-=Fe3+ D.當電流計指針歸零時,總反應達到平衡狀態 組卷:77引用:3難度:0.6
二、非選擇題(共84分)
-
28.甲氧基肉桂酸乙基己酯(圖中J)是一種理想的防曬劑,能有效吸收紫外線,安全性良好。其合成線路圖如圖:
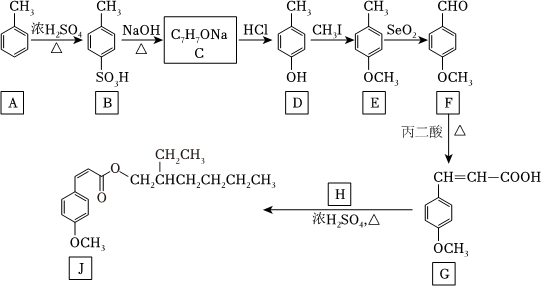
回答下列問題:
(1)由A生成B的反應類型為。有機物E的分子式為。丙二酸的結構簡式為。
(2)C的結構簡式為。
(3)H的結構簡式為。
(4)G與氫氣反應可得X(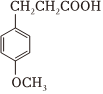 )。X有多種同分異構體,其中同時滿足下列條件同分異構體的結構簡式為:
)。X有多種同分異構體,其中同時滿足下列條件同分異構體的結構簡式為:
①核磁共振氫譜有四種峰;②與FeCl3溶液能發生顯色反應,且1mol該物質恰好能與3mol NaOH完全反應。
(5)以乙醇和丙二酸為原料合成聚巴豆酸乙酯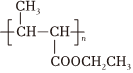 ,請補充完成以下合成路線(無機試劑可任選)。 一定條件
,請補充完成以下合成路線(無機試劑可任選)。 一定條件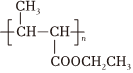 組卷:221引用:2難度:0.5
組卷:221引用:2難度:0.5 -
29.C、S和Cl元素的單質及化合物在工業生產中的有效利用備受關注。請回答下列問題:
(1)已知:Ⅰ.2SO2(g)+O2 (g)+2H2O(l)═2H2SO2 (aq)△H1;
Ⅱ.Cl2(g)+H2O(l)?HCl(aq)+HClO(aq)△H2;
Ⅲ.2HClO(aq)═2HCl(aq)+O2(g)△H3。
SO2(g)+Cl2 (g)+2H2O(l)=2HCl(aq)+H2SO4(aq)△H4=(用含有△H1、△H2和△H3的代數式表示)。
(2)25℃時,H2SO3溶液中各種含硫微粒的物質的量分數(δ)與溶液pH的變化關系如圖甲所示。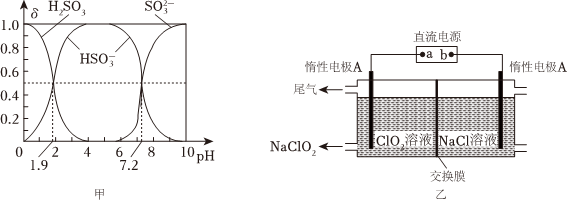
已知25℃時,NaHSO3的水溶液pH<7,解釋其原因為:。
(3)NaClO2是一種綠色消毒劑和漂白劑,工業上采用電解法制備NaClO2的原理如圖乙所示。
①交換膜應選用(填“陽離子交換膜”或“陰離子交換膜”)
②陽極的電極反應式為。
(4)一定溫度下,向2L恒容密閉容器中通入2 mol CO和1 mol SO2;發生反應2CO(g)+SO2(g)?S(l)+2CO2(g)△H=-270kJ/mol,若反應進行到20 min時達平衡,測得CO2的體積分數為0.5,則前20min的反應速率v(CO)=,該溫度下反應化學平衡常數K=。
(5)在不同條件下向2L恒容密閉容器中通入2mol CO和1 mol SO2,反應體系總壓強隨時間的變化如圖所示:
①圖(Ⅰ)中三組實驗從反應開始至達到平衡時,以v(CO)最大的為(填序號)
②與實驗a相比,c組改變的實驗條件可能是。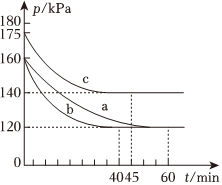 組卷:67引用:3難度:0.6
組卷:67引用:3難度:0.6


