2017-2018學年廣東省廣州市廣外、鐵一、廣附三校聯考高一(下)期末化學試卷
發布:2025/1/6 5:30:2
一、選擇題(每小題只有一個選項符合題意,每小題2分,共50分)
-
1.海洋資源包括海洋礦物資源、海水化學資源、海洋生物(水產)資源和海洋動力資源等,目前,人類對于海洋資源的開發已越來越廣泛而深入。下列有關說法正確的是( )
A.采用紅區吹出去法從海水中提取碘,涉及的反應主要為氧化還原反應 B.海水含鎂元素,可通過金屬鈉從海水中置換出金屬鎂 C.利用潮汐發電是將化學能轉化為電能 D.海底對金屬結核礦是錳、硼、鈦等的主要來源 組卷:4引用:1難度:0.5 -
2.下列有關元素的性質及其遞變規律正確的是( )
A.同主族元素形成的單質熔沸點自上而下逐漸升高 B.核外電子排布相同的微粒化學性質不一定相同 C.同主族元素含氧酸的酸性隨核電荷數的增加而減弱 D.非金屬元素的氣態氫化物的穩定性越強其沸點就越高 組卷:314引用:7難度:0.9 -
3.有關化學反應與能量變化的說法正確的是( )
A.化學反應中物質變化的同時一定發生能量變化 B.化學反應的能量變化都表現為熱量變化,包括吸熱和放熱 C.化學反應的焓變是斷裂舊鍵放熱與形成新鍵吸熱之間的差值 D.化學反應中能量變化的大小既與反應途徑有關又與物質的多少有關 組卷:2引用:1難度:0.6 -
4.對一建立平衡的某可逆反應,下列判斷正確的( )
A.平衡向正反應方向移動,化學平衡常數一定增大 B.平衡向正反應方向移動,正反應速率一定增大 C.平衡向正反應方向移動,反應物的轉化率一定增大 D.平衡向正反應方向移動,生成物的產量一定增大 組卷:4引用:1難度:0.5 -
5.下列根據元素周期表和元素周期律得出的推斷中正確的是( )
A.金屬元素原子最外層電子數減少,該金屬失電子能力越強 B.若存在簡單陰離子R2-,則元素R一定位于ⅥA族 C.A2+、B+、C3-三種離子具有相同的電子層結構,則微粒半徑r(A2+)>r(B+)>r(C3-) D.鋁位于周期表中金屬和非金屬的交界處,可作半導體材料 組卷:5引用:1難度:0.5 -
6.X、Y、Z、W為四種短周期元素,關于這四種元素的說法中正確的是( )
元素 X Y Z W 原子半徑/nm 0.077 0.075 0.102 0.099 最高正價或最低負價 +4 +5 -2 -1 A.1mol W的單質參加氧化還原反應時轉移的電子數一定為1 B.W、X、Y三種元素的最高價氧化物對應水化物的酸性依次增加 C.Y的氫化物與W的氫化物反應的產物中既含有共價鍵又含有離子鍵 D.0.3mol Cu分別與足量HYO3或H2ZO4的稀溶液反應均產生0.2mol氣體 組卷:1引用:1難度:0.5 -
7.甲、乙、丙、丁為原子序數依次增大的四種短周期元素。甲與乙可生成一種紅棕色有刺激性氣味的氣體;丙的周期數是族序數的3倍;丁原子最外層的電子數與甲的電子總數相同。下列敘述中正確的是( )
A.四種元素的簡單離子具有相同的電子層結構 B.丙與其他三種元素分別形成的化合物中只含有離子鍵 C.甲的氧化物對應的水化物均為強酸 D.乙分別與其他三種元素均可形成兩種或兩種以上的化合物 組卷:1引用:1難度:0.5 -
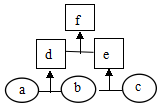 8.如圖所示,a、b、c均為非金屬單質,d、e均為含有10個電子的共價化合物,且分子所含原子個數:d>e,f為離子化合物。則下列說法錯誤的是( )
8.如圖所示,a、b、c均為非金屬單質,d、e均為含有10個電子的共價化合物,且分子所含原子個數:d>e,f為離子化合物。則下列說法錯誤的是( )A.穩定性:d>e B.常溫下,單質a呈氣態 C.單質c具有強氧化性 D.f受熱易分解為d和e 組卷:4引用:1難度:0.6 -
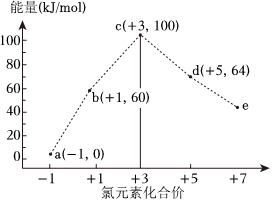 9.一定條件下,在水溶液中1mol Cl-,ClOx(x=1,2,3,4)的能量(kJ)相對大小如圖所示。下列有關說法正確的是( )
9.一定條件下,在水溶液中1mol Cl-,ClOx(x=1,2,3,4)的能量(kJ)相對大小如圖所示。下列有關說法正確的是( )A.e是 ClO-3B.b→a+c反應的活化能為60kJ?mol-1 C.a,b,c,d,e中c最穩定 D.b→a+d反應的熱化學方程式為3ClO-(aq)═ (aq)+2Cl-(aq)ΔH=-116kJ?mol-1ClO-3組卷:75引用:10難度:0.7
二、填空題(共4小題,每小題3分,滿分6分)
-
28.NOx、CO、SO2等大氣污染氣體的處理和利用是世界各國研究的熱點問題。
(1)已知:
a.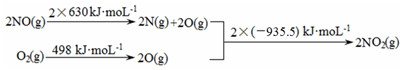
b.2NO(g)+O2(g)?2NO2 (g)△H1
2SO2 (g)+O2(g)?2SO3 (g)△H2=-196.6 kJ?mol-1
①△H1=。
②寫出NO2(g)與SO2(g)反應生成SO3 (g)和NO(g)的熱化學方程式。
(2)煤炭燃燒過程中釋放出大量的SO2,嚴重破壞生態環境。燃燒過程中加入石灰石可以把硫元素以的形式固定,從而降低SO2的排放。
①該反應的化學方程式是。煤炭燃燒過程中產生的CO又會與CaSO4發生化學反應,降低了脫硫效率。發生的兩個相關反應的熱化學方程式如下:
反應ⅰ:CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ?mol-1
反應ⅱ:CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=-175.6 kJ?mol-1
已知:反應ⅰ和反應ⅱ同時發生;反應ⅰ的速率大于反應ⅱ的速率。
②下列反應過程能量變化示意圖正確的是。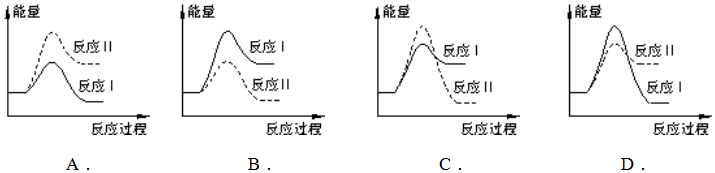
③如圖為實驗測得不同溫度下反應體系中CO初始體積百分數與平衡時固體產物中CaS質量百分數的關系曲線。則降低該反應體系中 SO2生成量的措施有。(填字母)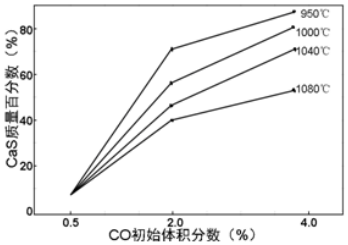
A.向該反應體系中投入石灰石
B.在合適的溫度區間內控制較低的反應溫度
C.提高CO的初始體積百分數
D.提高反應體系溫度組卷:2引用:1難度:0.4 -
29.化學反應速率與化學平衡的理論研究對化學工業生產有重要的意義。
Ⅰ.氨是一種重要的化工產品,是氮肥工業、有機合成工業以及制造硝酸、銨鹽和純堿等的原料。
(1)在一定溫度下,在固定體積的密閉容器中進行可逆反應:N2+3H2?2NH3 該可逆反應達到平衡的標志是。
A.3v(H2)正=2v(NH3)逆
B.單位時間生成m mol N2的同時消耗3m mol H2
C.容器內的總壓強不再隨時間而變化
D.混合氣體的密度不再隨時間而變化
E.a mol N≡N鍵斷裂的同時,有6a mol N-H鍵斷裂
F.N2、H2、NH3的分子數之比為1:3:2
(2)某化學研究性學習小組模擬工業合成氨的反應.在容積固定為2L的密閉容器內充入1mol N2和3mol H2,加入合適催化劑(體積可以忽略不計)后在一定溫度壓強下開始反應,并用壓力計監測容器內壓強的變化如表:
則從反應開始到25min時,以N2表示的平均反應速率=反應時間/min 0 5 10 15 20 25 30 壓強/MPa 16.80 14.78 13.86 13.27 12.85 12.60 12.60 。
該溫度下平衡常數K=。
Ⅱ.甲醇廣泛用于精細化工、塑料等領域,也是農藥、醫藥的重要原料之一,深加工后還可作為一種新型清潔燃料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,主要反應如下:
①CO(g)+2H2(g)?CH3OH(g)△H=-99 kJ?mol-1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58 kJ?mol-1
③CO2(g)+H2(g)?CO (g)+H2O(g)△H=+41 kJ?mol-1
(3)圖1中能表示反應①的平衡常數K隨溫度變化關系的曲線是。(填a或b)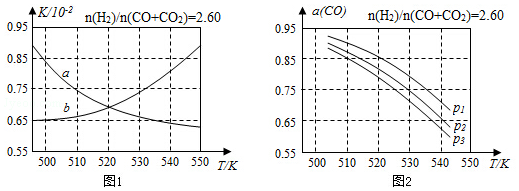
(4)合成氣的組成=2.60時體系中的CO平衡轉化率α(CO)與溫度和壓強的關系如圖2所示。圖中的壓強p1、p2、p3由大到小的順序為n(H2)n(CO+CO2);α(CO)隨溫度升高而減小,其原因是。
Ⅲ.丙烯腈(分子式C3H3N)作為合成纖維、合成橡膠和合成樹脂的基礎物質,是一種重要的化工原料。工業上以氨、丙烯(分子式C3H6)、氧氣為原料,在催化劑存在下生成丙烯腈(C3H3N)的熱化學方程式如下:C3H6(g)+NH3(g)+O2(g)?C3H3N(g)+3H2O(g)△H=-515 kJ?mol-1。32
(5)對于氣相反應,用某組分(B)的平衡壓強(pB)代替物質的濃度(cB )也可以表示平衡常數(記作KP),則上述反應的KP=。該反應能自發進行,其原因是。
(6)若其他條件不變,在恒容、溫度 時丙烯腈的物質的量與時間的圖象如圖(a)所示。請補充完成溫度為T2[化學平衡常數K(T1)>K(T2)]時丙烯腈的物質的量隨時間變化的示意圖。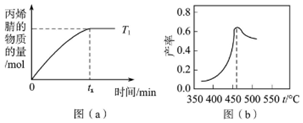
(7)圖(b)為在相同壓強下,經過相同反應時間測得的丙烯腈產率與反應溫度的關系曲線,最高產率對應溫度為460℃,則高于460℃時,丙烯腈的產率降低可能的原因:①有副反應發生;②; ③。組卷:37引用:1難度:0.3


