2020-2021學(xué)年河南省三門峽第一高級中學(xué)高三(上)開學(xué)化學(xué)試卷(8月份)
發(fā)布:2024/4/20 14:35:0
一、選擇題(共14個小題,每小題5分,共70分)
-
1.宋代《千里江山圖)描繪了山清水秀的美麗景色,歷經(jīng)千年色彩依然,其中綠色來自孔雀石顏料[主要成分為Cu(OH)2?CuCO3],青色來自藍(lán)銅礦顏料[主要成分為Cu(OH)2?2CuCO3]。下列說法錯誤的是( )
A.保存《千里江山圖》需控制溫度和濕度 B.孔雀石、藍(lán)銅礦顏料不易被空氣氧化 C.孔雀石、藍(lán)銅礦顏料耐酸耐堿 D.Cu(OH)2?CuCO3中銅的質(zhì)量分?jǐn)?shù)高于Cu(OH)2?2CuCO3 組卷:823引用:29難度:0.6 -
2.國家衛(wèi)健委公布的新型冠狀病毒肺炎診療方案指出,乙醚、75%乙醇、含氯消毒劑、過氧乙酸(CH3COOOH)、氯仿等均可有效滅活病毒。對于上述化學(xué)藥品,下列說法錯誤的是( )
A.CH3CH2OH能與水互溶 B.NaClO通過氧化滅活病毒 C.過氧乙酸相對分子質(zhì)量為76 D.氯仿的化學(xué)名稱是四氯化碳 組卷:967引用:34難度:0.8 -
3.打贏藍(lán)天保衛(wèi)戰(zhàn),提高空氣質(zhì)量。下列物質(zhì)不屬于空氣污染物的是( )
A.PM2.5 B.O2 C.SO2 D.NO 組卷:314引用:11難度:0.5 -
4.下列有關(guān)物質(zhì)的性質(zhì)與用途具有對應(yīng)關(guān)系的是( )
A.鋁的金屬活潑性強(qiáng),可用于制作鋁金屬制品 B.氧化鋁熔點(diǎn)高,可用作電解冶煉鋁的原料 C.氫氧化鋁受熱分解,可用于中和過多的胃酸 D.明礬溶于水并水解形成膠體,可用于凈水 組卷:424引用:15難度:0.6 -
5.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.0.1mol?L-1氨水溶液:Na+、K+、OH-、NO3- B.0.1mol?L-1鹽酸溶液:Na+、K+、SO42-、SiO32- C.0.1mol?L-1KMnO4溶液:NH4+、Na+、NO3-、I- D.0.1mol?L-1AgNO3溶液:NH4+、Mg2+、Cl-、SO42- 組卷:1415引用:20難度:0.5
二、解答題(共30分,除特別標(biāo)注,每空2分)
-
15.釩具有廣泛用途。黏土釩礦中,釩以+3、+4、+5價的化合物存在,還包括鉀、鎂的鋁硅酸鹽,以及SiO2、Fe3O4。采用如圖工藝流程可由黏土釩礦制備NH4VO3。
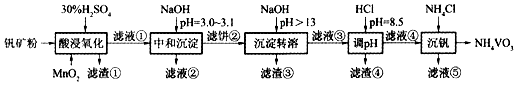
該工藝條件下,溶液中金屬離子開始沉淀和完全沉淀的pH如下表所示。
回答下列問題:金屬離子 Fe3+ Fe2+ Al3+ Mn2+ 開始沉淀pH 1.9 7.0 3.0 8.1 完全沉淀pH 3.2 9.0 4.7 10.1
(1)“酸浸氧化”需要加熱,其原因是。
(2)“酸浸氧化”中,VO+和VO2+被氧化成VO2+,同時還有離子被氧化。寫出VO+轉(zhuǎn)化為VO2+反應(yīng)的離子方程式。
(3)“中和沉淀”中,釩水解并沉淀為V2O5?xH2O,隨濾液②可除去金屬離子K+、Mg2+、Na+、,以及部分的。
(4)“沉淀轉(zhuǎn)溶”中,V2O5?xH2O轉(zhuǎn)化為釩酸鹽溶解。濾渣③的主要成分是。
(5)“調(diào)pH”中有沉淀生產(chǎn),生成沉淀反應(yīng)的化學(xué)方程式是。
(6)“沉釩”中析出NH4VO3晶體時,需要加入過量NH4Cl,其原因是。組卷:979引用:5難度:0.5 -
16.某同學(xué)利用Cl2氧化K2MnO4制備KMnO4的裝置如圖所示(夾持裝置略):

已知:錳酸鉀(K2MnO4)在濃強(qiáng)堿溶液中可穩(wěn)定存在,堿性減弱時易發(fā)生反應(yīng):3+2H2O═2MnO2-4+MnO2↓+4OH-MnO-4
回答下列問題:
(1)裝置A中a的作用是;裝置C中的試劑為;裝置A中制備Cl2的化學(xué)方程式為。
(2)上述裝置存在一處缺陷,會導(dǎo)致KMnO4產(chǎn)率降低,改進(jìn)的方法是。
(3)KMnO4常作氧化還原滴定的氧化劑,滴定時應(yīng)將KMnO4溶液加入(填“酸式”或“堿式”)滴定管中;在規(guī)格為50.00mL的滴定管中,若KMnO4溶液起始讀數(shù)為15.00mL,此時滴定管中KMnO4溶液的實(shí)際體積為(填標(biāo)號)。
A.15.00mL
B.35.00mL
C.大于35.00mL
D.小于15.00mL
(4)某FeC2O4?2H2O樣品中可能含有的雜質(zhì)為Fe2(C2O4)3、H2C2O4?2H2O,采用KMnO4滴定法測定該樣品的組成,實(shí)驗(yàn)步驟如下:
Ⅰ.稱取mg樣品于錐形瓶中,加入稀H2SO4溶解,水浴加熱至75℃.用c mol?L-1的KMnO4溶液趁熱滴定至溶液出現(xiàn)粉紅色且30s內(nèi)不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入適量還原劑將Fe3+完全還原為Fe2+,加入稀H2SO4酸化后,在75℃繼續(xù)用KMnO4溶液滴定至溶液出現(xiàn)粉紅色且30s內(nèi)不褪色,又消耗KMnO4溶液V2mL。
樣品中所含H2C2O4?2H2O(M=126g?mol-1)的質(zhì)量分?jǐn)?shù)表達(dá)式為。
下列關(guān)于樣品組成分析的說法,正確的是(填標(biāo)號)。
A.=3時,樣品中一定不含雜質(zhì)V1V2
B.越大,樣品中H2C2O4?2H2O含量一定越高V1V2
C.若步驟Ⅰ中滴入KMnO4溶液不足,則測得樣品中Fe元素含量偏低
D.若所用KMnO4溶液實(shí)際濃度偏低,則測得樣品中Fe元素含量偏高組卷:813引用:12難度:0.3


