2014-2015學年河北省石家莊市正定中學高三(上)周練化學試卷(10.10)
發布:2024/4/20 14:35:0
一、選擇題(本題包括13小題,每小題只有一個選項符合題意)
-
1.化學與生活、社會密切相關。下列說法正確的是( )
A.Si常用做信息高速公路的骨架--光導纖維的主要材料 B.“遼寧艦”上用于艦載機降落攔阻索的特種鋼纜,屬于新型無機非金屬材料 C.煤炭經氣化、液化和干餾等過程,可獲得清潔能源和重要的化工原料 D.PM2.5含有Pb、Cd、Cr、V、As等對人體有害的金屬元素 組卷:11引用:1難度:0.5 -
2.下列離子組在給定條件下離子共存判斷及反應的離子方程式均正確的是( )
選項 條件 離子組 離子共存判斷及反應的離子方程式 A 滴加氨水 Na+、Al3-、Cl-、NO3- 不能大量共存,
Al3++3OH-═Al(OH)3↓B 由水電離出的H+濃度為1×10-12mol?L-1 NH4+、Na+、NO3-、Cl- 一定能大量共存,NH4++H2O?MH3?H2O+H+ C pH=1的溶液 Fe2+、Al3+、SO42-、MnO4- 不能大量共存,5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O D 通入少量SO2氣體 K+、Na+、ClO-、SO42- 不能大量共存,2ClO-+SO2+H2O═2HClO+SO32- A.A B.B C.C D.D 組卷:53引用:20難度:0.7 -
3.無水疊氮酸(HN3)是無色易揮發、易爆炸的油狀液體,沸點308.8K,其水溶液較穩定,用于有機合成、制造雷管等。制備原理:N2H4+HNO2=HN3+2H2O.則下列說法正確的是( )
A.HN3分子間存在氫鍵,故其沸點較高,化學性質較穩定 B.上述反應中的氧化劑是HNO2 C.N2H4為分子晶體,HN3為離子晶體 D.上述反應中每生成1mol HN3,轉移電子 mol83組卷:2引用:2難度:0.6
三、非選擇題:包括必考題和選考題兩部分,第22題~第32題為必考題,每個小題考生都必須作答.第33題~第40題為選考題,考生根據要求作答.
-
10.由碳元素構成的各種單質和化合物始終都是科學家研究的重要對象。
(1)如圖為碳及其氧化物的變化關系圖,若①變化是置換反應則其化學方程式可為(寫一個即可);除①外,圖中哪些變化過程是吸熱反應(填序號)。
(2)汽車尾氣中的一氧化碳是大氣污染物,可通過反應:CO(g)+O2(g)?CO2(g),降低其濃度。某溫度下,在兩個容器中進行上述反應,容器中各物質的起始濃度及正逆反應速率關系如下表所示。請填寫表中的空格。12
(3)CCS 技術是將工業和有關能源產業中所生產的CO2進行捕捉與封存的技術,被認為是拯救地球、應對全球氣候變化最重要的手段之一。其中一種以天然氣為燃料的“燃燒前捕獲系統”的簡單流程圖如圖1所示(部分條件及物質未標出)。回答下列問題:容器編號 c(CO)/mol?L-1 c(O2)/mol?L-1 c(CO2)/mol?L-1 v(正)和v(逆)比較 Ⅰ 2.0×10-4 4.0×10-4 4.0×10-2 v(正)=v(逆) Ⅱ 3.0×10-4 4.0×10-4 5.0×10-2 v(正) v(逆)
CH4在催化劑作用下實現第一步,也叫CH4不完全燃燒,1gCH4不完全燃燒反應放出2.21kJ熱量,寫出該反應的熱化學方程式。
(4)甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上可用(3)題轉化中得到的合成氣制備甲醇。反應為CO(g)+2H2(g)?CH3OH(g),某溫度下,在容積為2L的密閉容器中進行該反應,其相關數據見圖2: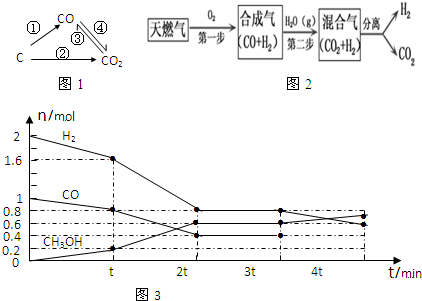
(5)根據圖3計算,從反應開始到t min時,用H2濃度變化表示的平均反應速率v(H2)=
②t min至2t min時速率變化的原因可能是;
③3t min時對反應體系采取了一個措施,至4t min時CO的物質的量為0.5mol,請完成上圖CO的曲線。組卷:1引用:2難度:0.5
三、化學-選修3物質結構與性質(共1小題,滿分15分)
-
 11.開發新型儲氫材料是氫能利用的重要研究方向。
11.開發新型儲氫材料是氫能利用的重要研究方向。
(1)Ti(BH4)3是一種儲氫材料,可由TiCl4和LiBH4反應制得。
①Ti的基態原子外圍電子排布式為。
②LiBH4由Li+和BH4-構成,BH4-的空間構型是,BH4-中B原子的雜化類型為,LiBH4中存在的作用力有。
③Li、B、H元素的電負性由大到小排列順序為。
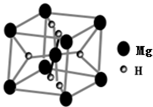
(2)MgH2也是一種儲氫材料,其晶胞結構如圖所示。已知該晶胞的體積為V cm3,則該晶體的密度為[用V、NA表示,其中NA為阿伏加德羅常數的值)].MgH2要密封保存,遇水會緩慢反應,反應的化學方程式為。
(3)金屬晶體中存在一種堆積方式叫立方最密堆積,其配位數為,空間利用率為。一種具有儲氫功能的銅合金晶體具有立方最密堆積的結構,晶胞中Cu原子處于面心,Au原子處于頂點位置,氫原子可進入到由Cu原子與Au原子構成的四面體空隙中。若將Cu原子與Au原子等同看待,該晶體儲氫后的晶胞結構與CaF2的結構相似,該晶體儲氫后的化學式為。組卷:4引用:1難度:0.7


