2021-2022學年北京交大附中高一(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意,本題共21小題,每小題2分,共42分)
-
1.下列我國古代的技術應用中,不涉及氧化還原反應的是( )
A.  煅燒貝殼
煅燒貝殼B.  糧食釀醋
糧食釀醋C.  古法煉鐵
古法煉鐵D.  火藥爆炸組卷:73引用:12難度:0.9
火藥爆炸組卷:73引用:12難度:0.9 -
2.下列物質中,不屬于電解質的是( )
A.Cu B.K2SO4 C.HNO3 D.NaOH 組卷:64引用:12難度:0.8 -
3.當光束通過下列分散系時,能觀察到丁達爾效應的是( )
A.NaCl溶液 B.蔗糖溶液 C.CuSO4溶液 D.AgI膠體 組卷:20引用:4難度:0.8 -
4.下列關于物質分類的敘述中,不正確的是( )
A.H2SO4屬于酸 B.石灰水屬于純凈物 C.NO屬于氧化物 D.NaHCO3屬于鹽 組卷:46引用:2難度:0.8 -
5.下列關于金屬鈉的描述中,不正確的是( )
A.有銀白色金屬光澤 B.在空氣中燃燒只生成氧化鈉 C.具有很強的還原性 D.在空氣中燃燒發出黃色火焰 組卷:59引用:9難度:0.6 -
6.核外電子數相同、所顯電性和所帶電量也相同的微粒稱為等電子等質子體.下列各組內的兩種微粒屬于等電子等質子體的是( )
A.Na+和Mg2+ B.O2-和Mg2+ C.F-和Cl- D.Na+和NH4+ 組卷:35引用:2難度:0.9 -
7.在pH=1的無色溶液中,能夠大量共存的離子組是( )
A.Cu2+、Cl-、Ba2+、Na+ B.K+、CO32-、Na+、Cl- C.K+、Ba2+、OH-、NO3- D.Mg2+、Na+、Cl-、SO42- 組卷:77引用:7難度:0.9 -
8.某溶液中僅含有Na+、Mg2+、SO42-、Cl-四種離子,其物質的量濃度比為c(Na+):c(Mg2+):c(Cl-)=3:4:5,若Na+的物質的量濃度為3mol?L-1,則SO42-的物質的量濃度為( )
A.2 mol?L-1 B.3 mol?L-1 C.4 mol?L-1 D.8 mol?L-1 組卷:78引用:7難度:0.7 -
9.下列反應的離子方程式書寫不正確的是( )
A.碳酸鈉溶液與足量鹽酸反應:CO32-+2H+═CO2↑+H2O B.碳酸氫鈉溶液與足量鹽酸反應:HCO3-+H+═CO2↑+H2O C.氫氧化鋇溶液與硫酸銅溶液反應:Ba2++SO42-═BaSO4↓ D.鐵與稀鹽酸反應:Fe+2H+═Fe2++H2↑ 組卷:33引用:1難度:0.7
二、第Ⅱ卷(共58分)
-
26.實驗小組制備高鐵酸鉀(K2FeO4)并探究其性質。
資料:
①K2FeO4為紫色固體,干燥品在室溫下穩定,在堿性溶液中較穩定。
隨著堿性的減弱,穩定性下降,與水反應放出氧氣。
②K2FeO4通過強烈的氧化作用可迅速殺滅細菌,有消毒作用,同時不會產生有害物質。
③K2FeO4與水反應還能產生具有強吸附性的Fe(OH)3膠體,可除去水中細微的懸浮物,有凈水作用。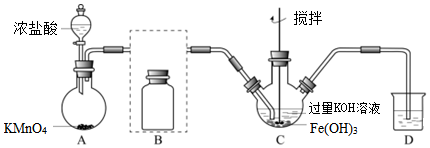
(1)K2FeO4中鐵元素的化合價為。
(2)A為氯氣發生裝置。發生反應的方程式為:KMnO4+HCl═MnCl2+Cl2↑+KCl+H2O。配平上述方程式,并用單線橋分析該氧化還原反應的電子轉移情況。
(3)裝置B是為了除去Cl2中混有的HCl雜質,將除雜裝置B補充完整并標明所用試劑。
(4)D中盛放的是溶液。
(5)C中得到紫色固體K2FeO4和溶液,請判斷氧化性:Cl2K2FeO4(填“>”“=”或“<”),C中通Cl2制得K2FeO4的化學方程式為,同時還發生了另一個反應的離子方程式是。
(6)下列關于K2FeO4的說法中,正確的是。
A.是強氧化性的鹽
B.固體保存需要防潮
C.其凈水優點有:作用快、安全性好、無異味
(7)將K2FeO4與水反應的化學方程式補充完整:4K2FeO4+H2O═Fe(OH)3(膠體)+()+KOH。組卷:65引用:1難度:0.4 -
27.研究小組進行如圖1所示實驗,試劑A為0.2 mol/LCuSO4溶液,發現鋁條表面無明顯變化,于是改變實驗條件,探究鋁和CuSO4溶液、CuCl2溶液反應的影響因素。用不同的試劑A 進行實驗1~實驗4,并記錄實驗現象
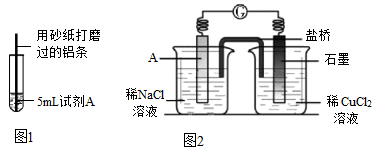
(1)實驗1中,鋁條表面析出紅色固體的反應的離子方程式為實驗序號 試劑A 實驗現象 1 0.2 mol/LCuCl2溶液 鋁條表面有氣泡產生,并有紅色固體析出 2 0.2 mol/LCuSO4 溶液,再加入一定質量的NaCl固體 開始鋁條表面無明顯變化,加NaCl后,鋁條表面有氣泡產生,并有紅色固體析出 3 2 mol/LCuSO4溶液 鋁條表面有少量氣泡產生,并有少量紅色固體 4 2 mol/LCuCl2溶液 反應非常劇烈,有大量氣泡產生,溶液變成棕褐色,有紅色固體和白色固體生成 。
(2)實驗2的目的是證明銅鹽中的陰離子Cl-是導致實驗1中反應迅速發生的原因,實驗2中加入NaCl固體的質量為g。
(3)實驗3的目的是。
(4 )經檢驗可知,實驗4中白色固體為CuCl.甲同學認為產生白色固體的原因可能是發生了Cu+CuCl2=2CuCl 的反應,他設計了如圖2所示實驗證明該反應能夠發生。
①A極的電極材料是。
②能證明該反應發生的實驗現象是。
(5)為探究實驗4中溶液呈現棕褐色的原因,分別取白色CuCl固體進行以下實驗:
查閱資料知:CuCl難溶于水,能溶解在Cl-濃度較大的溶液中,生成[CuCl2]-絡離子,用水稀釋含[CuCl2]-的溶液時會重新析出CuCl沉淀。實驗序號 實驗操作 實驗現象 i 加入濃NaCl溶液 沉淀溶解,形成無色溶液 ii 加入飽和AlCl3溶液 沉淀溶解,形成褐色溶液 iii 向i所得溶液中加入2 mol/LCuCl2溶液 溶液由無色變為褐色
①由上述實驗及資料可推斷,實驗4中溶液呈棕褐色的原因可能是[CuCl2]-與作用的結果。
②為確證實驗4所得的棕褐色溶液中含有[CuCl2]-,應補充的實驗是。
(6)上述實驗說明,鋁和CuSO4溶液、CuCl2溶液的反應現象與有關。組卷:71引用:6難度:0.5


