2021-2022學年內蒙古阿拉善盟一中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共17小題,每題1分,共17分.在每小題給出的四個選項中,只有一項是符合題目要求的.
-
1.生活中處處有化學,下列有關說法正確的是( )
A.天然弱堿性水呈堿性的原因是其中含有較多的Mg2+、Ca2+等離子 B.利用SO2的漂白性,可使酸性高錳酸鉀溶液褪色 C.生活中用電解食鹽水的方法制取消毒液,運用了鹽類的水解原理 D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的紅色逐漸褪去 組卷:27引用:1難度:0.7 -
2.在強酸性溶液中能大量共存的無色透明離子組是( )
A.K+、Na+、 、NO-3MnO-4B.Mg2+、Na+、Cl-、 SO2-4C.K+、Na+、Br-、Cu2+ D.Na+、Ba2+、OH-、 SO2-4組卷:70引用:11難度:0.9 -
3.下列變化過程,屬于放熱反應的是( )
①NH4Cl固體溶于水②炸藥爆炸③食物因氧化而腐敗④鋁熱反應⑤酸堿中和反應⑥煅燒石灰石制生石灰⑦溴蒸氣液化A.②③④⑤⑦ B.①②④⑤ C.②③④⑤ D.①②③⑥⑦ 組卷:57引用:4難度:0.8 -
4.對于反應A(g)+3B(g)═2C(g)來說,下列反應速率最快的是( )
A.V(A)=0.3 mol L-1min-1 B.V(B)=0.6 mol L-1min-1 C.V(C)=0.5 mol L-1min-1 D.V(A)=0.01 mol L-1S-1 組卷:114引用:3難度:0.9 -
5.下列選項描述的過程能實現化學能轉化為電能的是( )



A.電池充電 B.光合作用 C.手機電池工作 D.太陽能板充電 A.A B.B C.C D.D 組卷:63引用:1難度:0.8 -
6.下列現象不能用鹽的水解解釋的是( )
A.銅綠的生成 B.泡沫滅火器滅火 C.銨態氮肥與草木灰不得混用 D.NH4Cl溶液可作焊接金屬的除銹劑 組卷:12引用:1難度:0.7 -
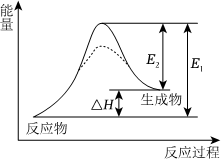 7.反應X(s)+Y(g)═3Z(g)的能量變化如圖所示。下列判斷錯誤的是( )
7.反應X(s)+Y(g)═3Z(g)的能量變化如圖所示。下列判斷錯誤的是( )A.加入催化劑,活化分子的百分數增大,E1和E2均減小 B.ΔH=+(E1-E2)kJ?mol-1 C.該反應在低溫下能自發進行 D.升高溫度,活化分子的百分數增大 組卷:65引用:5難度:0.5 -
8.下列與金屬腐蝕有關的說法,正確的是( )
A.  燃氣灶的中心部位容易生銹,主要是由于高溫下鐵發生化學腐蝕
燃氣灶的中心部位容易生銹,主要是由于高溫下鐵發生化學腐蝕B.  滴加少量K3[Fe(CN)6]溶液,沒有藍色沉淀出現
滴加少量K3[Fe(CN)6]溶液,沒有藍色沉淀出現C.  鐵釘易被腐蝕
鐵釘易被腐蝕D.  用犧牲鎂塊的方法來防止地下鋼鐵管道的腐蝕,鎂塊相當于原電池的正極組卷:51引用:2難度:0.6
用犧牲鎂塊的方法來防止地下鋼鐵管道的腐蝕,鎂塊相當于原電池的正極組卷:51引用:2難度:0.6 -
9.已知碳、一氧化碳、晶體硅的燃燒熱分別是ΔH1=-akJ?mol-1、ΔH2=-bkJ?mol-1和ΔH3=-ckJ?mol-1,則工業冶煉晶體硅反應2C(s)+SiO2(s)═Si(s)+2CO(g)的ΔH為( )
A.(2b+c-2a)kJ?mol-1 B.(2a-2b-c)kJ?mol-1 C.(a+2b-c)kJ?mol-1 D.(b+c-2a)kJ?mol-1 組卷:201引用:2難度:0.5 -
10.下列離子方程式書寫正確的是( )
A.用濃鹽酸與MnO2反應制取少量氯氣:MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O B.硫酸溶液與氫氧化鋇溶液混合:H++ +Ba2++OH-═BaSO4↓+H2OSO2-4C.Cu溶于足量濃硝酸:Cu+2 +4H+═Cu2++2NO2↑+2H2ONO-3D.FeCl3溶液與Cu反應:Fe3++Cu=Fe2++Cu2+ 組卷:7引用:3難度:0.7 -
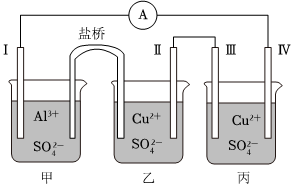 11.某化學興趣小組組裝了如圖所示的實驗裝置,電極Ⅰ為Al,電極Ⅱ、Ⅳ為石墨,電極Ⅲ為銅,鹽橋中含KCl,下列說法正確的是( )
11.某化學興趣小組組裝了如圖所示的實驗裝置,電極Ⅰ為Al,電極Ⅱ、Ⅳ為石墨,電極Ⅲ為銅,鹽橋中含KCl,下列說法正確的是( )A.電流方向:電極Ⅰ→電極Ⅳ B.鹽橋中的K+向電極Ⅰ作定向移動 C.電極Ⅲ為陽極,電極反應式為Cu2++2e-=Cu D.乙池中c(Cu2+)濃度減小,丙池中c(Cu2+)濃度不變 組卷:50引用:3難度:0.5
三、非選擇題:本題共4小題,共57分.
-
33.滴定實驗是化學學科中重要的定量實驗。請回答下列問題:
(1)酸堿中和滴定:用標準鹽酸滴定未知濃度的NaOH溶液。
①酸式滴定管、堿式滴定管、溫度計、量筒、玻璃棒、燒杯。若要進行中和滴定實驗,還缺少的玻璃儀器是。
②若在接近滴定終點時,用少量蒸餾水將錐形瓶內壁沖洗一下,再繼續滴定至終點,則所測得NaOH溶液濃度( 填“偏大”、“偏小”或“無影響”)。
(2)氧化還原滴定:用標準高錳酸鉀溶液滴定未知濃度的草酸(H2C2O4)溶液。取草酸溶液置于錐形瓶中,加入適量稀硫酸,用濃度為0.1000mol?L-1的高錳酸鉀溶液滴定
①寫出該反應的化學方程式,滴定時,KMnO4溶液應裝在(“酸”或“堿”)式滴定管中,判定滴定終點方法為。
②表格中記錄了實驗數據:
該草酸溶液的物質的量濃度為滴定次數 待測液體積(mL) 標準KMnO4溶液(mL) 滴定前讀數 滴定后讀數 第一次 25.00 0.50 20.40 第二次 25.00 3.00 23.00 第三次 25.00 4.00 24.10 。
(3)Mohr法是沉淀滴定法中常用的銀量法的一種滴定終點的確定方法。在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定溶液中Cl-,利用Ag+與CrO42-生成磚紅色沉淀,指示到達滴定終點.當溶液中Cl-恰好沉淀完全(濃度等于1.0×10-6mol?L-1)時,溶液中c(Ag+)為mol?L-1,此時溶液中c(CrO42-)等于mol?L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。組卷:46引用:3難度:0.7 -
34.研究氮的固定及含氮化合物的轉化對工農業發展及消除環境污染有重要的意義.
已知:
Ⅰ.N2(g)+3H2(g)?2NH3(g)ΔH1=-92.4kJ?mol-1
Ⅱ.N2(g)+O2(g)?2NO(g)ΔH2=+180kJ?mol-1
Ⅲ.2NO(g)+O2(g)?2NO2(g)ΔH3=-112.3kJ?mol-1
請回答下列問題:
(1)反應N2(g)+2O2(g)═2NO2(g)ΔH=.
(2)反應Ⅰ是工業固氮的重要反應,在體積為2L的恒溫恒容密閉容器中,充入1molN2和3molH2,5min末達到平衡,此時容器內壓強變為起始壓強的0.75倍.
①下列事實可以判斷該反應達到平衡狀態的(填字母).
a.相同時間內每消耗0.1molN2的同時消耗0.2molNH3
b.=c(N2)c(H2)13
c.混合氣體的密度不再發生變化時
d.氫氣的分壓不再發生變化時
②5min內該反應的平均反應速率v(N2)=.
③若將容器體積擴大一倍,再次平衡后該反應的化學平衡常數會(填“增大”“減小”或“不變”,下同),N2和H2的轉化率之比會α(N2)α(H2).
(3)反應Ⅲ是由以下兩步反應完成:
ⅰ.2NO(g)?N2O2(g)ΔH4<0
ⅱ.N2O2(g)+O2(g)?2NO2(g)ΔH5<0
①ΔH4-112.3kJ?mol-1(填“>”“=”或“<”,下同);若第ⅰ步反應為快反應,則活化能E(i)E(ii).
②若反應ⅱ的反應速率v正=k正×c(N2O2)?c(O2),v逆=k逆×c2(NO2);則該反應的化學平衡常數K=(用含“k正”和“k逆”的代數式表示).組卷:19引用:1難度:0.5


