2019-2020學年江西省南昌市安義中學高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共16小題,每小題3分,共48分。每小題只有一個選項符合題目要求)
-
1.下列說法不正確的是( )
A.乙醚和乙醇互為同分異構體 B.苯與苯乙烯具有相同最簡式但不是同系物 C. 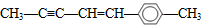 分子中最多可以有20個原子共平面
分子中最多可以有20個原子共平面D.CH3CH2CH2CH3和C(CH3)4互為同系物 組卷:33引用:1難度:0.8 -
2.常溫下,有關鹽酸與醋酸溶液的說法正確的是( )
A.pH=2.0的鹽酸和醋酸溶液,等體積混合后溶液的pH>2.0 B.濃度為0.1mol?L-1等體積的鹽酸和醋酸溶液加水稀釋10倍后,c(Cl-)>c(CH3COO-) C.相同濃度的兩溶液,分別與NaOH固體反應后呈中性的溶液中(忽略溶液體積變化):c(CH3COO-)=c(Cl-) D.等濃度的鹽酸和醋酸與足量的鋅反應產生氣體的體積(同溫同壓時)相同 組卷:5引用:1難度:0.7 -
3.某溫度下重水(D2O)的離子積常數為1.6×10-15,用定義pH一樣來規定pD=-lg{c(D+)},則該溫度下,下列敘述正確的是( )
A.純凈的重水(D2O)中,pD=7 B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0 C.純凈的重水中,c(D+)=c(OD-) D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0 組卷:41引用:3難度:0.7 -
4.已知常溫下濃度為0.1mol/L的下列溶液的pH如表,下列有關說法正確的是( )
溶質 NaF NaClO Na2CO3 pH 7.5 9.7 11.6 A.在相同溫度下,同濃度的三種酸溶液的導電能力順序:H2CO3<HClO<HF B.向上述NaClO溶液中通HF氣體至恰好完全反應時:c(Na+)>c(F-)>(H+)>c(HClO)>c(OH-) C.根據上表,水解方程式ClO-+H2O?HClO+OH-的水解常數K=10-7.6 D.若將CO2通入0.1mol/L Na2CO3溶液中至溶液中性,則溶液中2c(CO32-)+c(HCO3-)=0.1mol/L 組卷:10引用:1難度:0.7 -
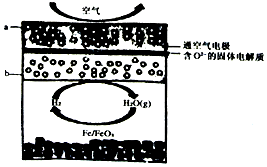 5.世界某著名學術刊物近期介紹了一種新型中溫全瓷鐵一空氣電池,其結構如圖所示。下列有關該電池放電時的說法正確的是( )
5.世界某著名學術刊物近期介紹了一種新型中溫全瓷鐵一空氣電池,其結構如圖所示。下列有關該電池放電時的說法正確的是( )A.O2-由b極移向a極 B.正極的電極反應式為FeOx+2xe-═Fe+xO2- C.若有22.4L(標準狀況)空氣參與反應,則電路中有4mol 電子轉移 D.鐵表面發生的反應為xH2O(g)+Fe═FeOx+xH2 組卷:19引用:2難度:0.7 -
6.下列關于乙烯與苯的說法正確的是( )
A.分子中均含有碳碳雙鍵 B.常溫常壓下,它們均呈氣態 C.都能使酸性KMnO4溶液褪色 D.分子中所有原子均處于同一平面 組卷:164引用:4難度:0.6 -
7.下列試劑不能用來鑒別乙醇和乙酸的是( )
A.紫色石蕊試液 B.碳酸鈉溶液 C.蒸餾水 D.酸性高錳酸鉀溶液 組卷:79引用:5難度:0.5
二、非選擇題(本大題共5小題,共52分。)
-
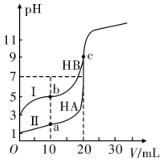 20.現有HA、HB 和H2C三種酸。室溫下用0.1mol?L-1NaOH溶液分別滴定20.00 mL濃度均為0.1mol?L-1的HA、HB兩種酸的溶液,滴定過程中溶液的pH隨滴入的NaOH 溶液體積的變化如圖所示。
20.現有HA、HB 和H2C三種酸。室溫下用0.1mol?L-1NaOH溶液分別滴定20.00 mL濃度均為0.1mol?L-1的HA、HB兩種酸的溶液,滴定過程中溶液的pH隨滴入的NaOH 溶液體積的變化如圖所示。
(1)a點時的溶液中由水電離出的c(H+)=mol?L-1。
(2)曲線I 上的c點對應的溶液中各離子濃度由大到小的順序為;b 點對應的溶液中c(HB)c(B-)(填“>”“<”或“=”)。
(3)已知常溫下向0.1mol?L-1的NaHC 溶液中滴入幾滴石蕊試液后溶液變成紅色。
①若測得此溶液的pH=1,則NaHC的電離方程式為。
②若在此溶液中能檢測到H2C 分子,則此溶液中c(C2-)c(H2C)(填“>”“<”或“=”)。
③若H2C 的一級電離為H2C=H++HC-,常溫下0.1mol?L-1H2C溶液中的c(H+ )=0.11mol?L-1,則0.1mol?L-1NaHC溶液中的c(H+)0.01mol?L-1(填“>”“<”或“=”)。組卷:94引用:5難度:0.5 -
21.氯化亞砜(SOCl2)是一種液態化合物,沸點為77℃,在農藥、醫藥行業中用途廣泛。SOCl2遇水劇烈反應,液面上產生白霧,并有帶刺激性氣味的氣體產生。實驗室合成原理為:SO2+Cl2+SCl2═2SOCl2,裝置如圖所示。請回答以下問題:
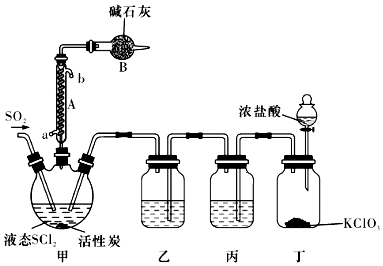
(1)儀器A的名稱是,裝置乙中盛放的試劑是裝置B的作用是。
(2)裝置丁中發生反應的離子方程式為。
(3)蒸干AlCl3溶液不能得到無水AlCl3,使SOCl2與AlCl3?6H2O混合加熱,可得到無水AlCl3,試解釋原因:。
(4)若反應中消耗的Cl2的體積為896mL(已轉化為標準狀況下,SCl2、SO2足量),最后得到純凈的SOCl24.76g,則SOCl2的產率為。(保留三位有效數字)
(5)常溫下,將0.01mol SOCl2加入100mL 0.3mol/L NaOH溶液中恰好完全反應,所得溶液呈(填“酸”、“堿”或“中”)性,溶液中所有陰離子的濃度大小順序為。(已知H2SO3的Ka1=1.52×10-2,Ka2=1.02×10-7)
(6)將少量SOCl2滴入5mL 1mol/L的AgNO3溶液中,有白色沉淀生成,該白色沉淀的成分是。(填化學式)組卷:5引用:1難度:0.5


