2022-2023學年重慶市文理學院附中高二(上)第一次月考化學試卷
發布:2024/9/26 0:0:1
一、單選題(48分,每小題只有一個正確選項)
-
1.“藍天保衛戰”,是黨的十九大作出的重大決策部署,事關經濟高質量發展和美麗中國建設。下列做法不利于打贏“藍天保衛戰”的是( )
A.植樹造林,抑塵防沙 B.推廣使用燃煤脫硫技術,防治SO2污染 C.加大石油、煤炭的使用 D.研發新能源汽車,減少尾氣排放 組卷:23引用:4難度:0.6 -
2.光氣又稱碳酰氯,有劇毒,可發生反應:COCl2(g)?CO(g)+Cl2(g)△H>0.當反應達到平衡時,下列措施不能提高COCl2轉化率的是( )
A.升溫 B.恒容通入惰性氣體 C.減壓 D.恒壓通入惰性氣體 組卷:37引用:5難度:0.6 -
3.下列反應中△H>0,△S>0的是( )
A.CaCO3 (s)=CaO(s)+CO2(g) B.NH3(g)+HCl(g)=NH4Cl(s) C.4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) D.任何溫度下均能自發進行2H2O2(l)=2H2O(l)+O2(g) 組卷:219引用:6難度:0.6 -
4.下列熱化學方程式及其有關敘述正確的是( )
A.氫氣的燃燒熱為285.8kJ?mol-1,則水分解的熱化學方程式為2H2O(l)═2H2(g)+O2(g)△H=+285.8kJ?mol-1 B.已知2C(石墨,s)+O2(g)═2CO(g)△H=-221kJ?mol-1,則石墨的燃燒熱110.5kJ?mol-1 C.已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,則在一定條件下將1mol N2和3mol H2置于一密閉容器中充分反應,放出92.4kJ的熱量 D.已知乙炔的燃燒熱為1299.6kJ/mol,則表示乙炔燃燒熱的熱化學方程C2H2(g)+ O2(g)=2CO2(g)+H2O(l)△H=-1299.6kJ?mol-152組卷:57引用:8難度:0.6 -
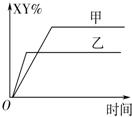 5.在密閉容器中,反應X2(g)+Y2(g)?2XY(g)△H<0達到甲平衡,僅改變某一條件后,達到乙平衡.對此過程的分析正確的是( )
5.在密閉容器中,反應X2(g)+Y2(g)?2XY(g)△H<0達到甲平衡,僅改變某一條件后,達到乙平衡.對此過程的分析正確的是( )A.可能是減小了反應物的濃度,反應物X2轉化率一定減小 B.可能是加入了催化劑,反應物X2百分含量(X2%)將增大 C.可能是縮小了容器的體積,但該反應的平衡常數保持不變 D.可能是升高了溫度,該反應的平衡常數一定減小 組卷:37引用:4難度:0.5
二、填空題(52分,每小題只有一個正確選項)
-
15.Ⅰ.一定條件下,體積為1L的密閉容器中發生如下反應:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)ΔH═+148.9kJ?mol-1。
(1)下列各項中能說明該反應已達化學平衡狀態的是(填字母序號)。
A.v消耗(SiF4)═4v生成(HF)
B.容器內氣體壓強不再變化
C.容器內氣體的總質量不再變化
D.HF的體積分數不再變化
(2)反應過程中測定的部分數據如下表(表中t2>t1)所示。
通過a或b的值及化學平衡原理說明t1時反應是否達到化學平衡狀態:反應時間/min n(SiF4)/mol n(H2O)/mol 0 1.20 2.40 t1 0.80 a t2 b 1.60 。
Ⅱ.碳及其化合物有廣泛的用途。
(3)反應C(s)+H2O(g)?CO(g)+H2(g)ΔH═+131.3kJ?mol-1,達到平衡后,體積不變時,以下有利于提高H2產率的措施是。
A.增加碳的用量
B.升高溫度
C.用CO吸收劑除去CO
D.加入催化劑
(4)已知:C(s)+CO2(g)?2CO(g)ΔH═+172.5kJ?mol-1。則反應CO(g)+H2O(g)?CO2(g)+H2(g)的ΔH═kJ?mol-1。
(5)在一定溫度下,將CO(g)和H2O(g)各0.16mol分別通入到體積為2.0L的恒容密閉容器中,發生以下反應:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下數據:
①其它條件不變,降低溫度,達到新平衡前v(逆)t/min 2 4 7 9 n(H2O)/mol 0.12 0.11 0.10 0.10 v(正)(填“>”、“<”或“═”);
②該溫度下,此反應的平衡常數K═;
③其它條件不變,再充入0.1molCO和0.1molH2O(g),平衡時CO的體積分數(填“增大”、“減小”或“不變”)。組卷:0引用:2難度:0.5 -
16.將濃度均為0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定時間后溶液變為藍色。該實驗是一種“碘鐘實驗”。某小組同學在室溫下對該“碘鐘實驗”的原理進行探究。
【資料】
該“碘鐘實驗”的總反應:H2O2 +2S2O32-+2H+═S4O62-+2H2O
反應分兩步進行:
反應A:H2O2 +2I-+2H+═I2+2H2O
反應B:……
(1)反應B的離子方程式是。對于總反應,I-的作用相當于。
(2)為證明反應A、B的存在,進行實驗Ⅰ。
a.向酸化的H2O2溶液中加入試劑X的水溶液,溶液變為藍色。
b.再向得到的藍色溶液中加入Na2S2O3溶液,溶液的藍色褪去。
試劑X是。
試劑
(3)為探究溶液變藍快慢的影響因素,進行實驗Ⅱ、實驗Ⅲ。
(溶液濃度均為0.01 mol/L)
溶液從混合時的無色變為藍色的時間:實驗Ⅱ是30 min、實驗Ⅲ是40 min。用量(ML)
序號H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液
(含淀粉)
H2O實驗Ⅱ 5 4 8 3 0 實驗Ⅲ 5 2 x y z
①實驗Ⅲ中,x、y、z所對應的數值分別是。
②對比實驗Ⅱ、實驗Ⅲ,可得出的實驗結論是。
(4)為探究其他因素對該“碘鐘實驗”的影響,進行實驗Ⅳ.(溶液濃度均為0.01 mol/L)
實驗過程中,溶液始終無明顯顏色變化。用量(mL)
號
試劑H2O2
溶液H2SO4
溶液Na2S2O3
溶液KI溶液(含淀粉)
H2O實驗Ⅳ 4 4 9 3 0
試結合該“碘鐘實驗”總反應方程式及反應A與反應B速率的相對快慢關系,解釋實驗Ⅳ未產生顏色變化的原因:。組卷:136引用:17難度:0.5


