2022-2023學(xué)年浙江省“七彩陽光”新高考研究聯(lián)盟高二(上)期中化學(xué)試卷
發(fā)布:2024/10/17 2:0:2
一、選擇題(本大題共25小題每小題2分,共50分。每小題列出的四個(gè)備選項(xiàng)中只有一個(gè)是符合題目要求的,不選、多選、錯(cuò)選均不得分)
-
1.化學(xué)與生活息息相關(guān),下列說法不正確的是( )
A.冰淇淋的運(yùn)輸常用干冰來保冷是利用干冰升華發(fā)生吸熱反應(yīng) B.食品中添加抗氧化劑可減緩食品變質(zhì)速率 C.“刀耕火種”的原理是以灰肥田,降低土壤酸度 D.打開啤酒瓶蓋子會(huì)有氣泡逸出與平衡的移動(dòng)有關(guān) 組卷:2引用:2難度:0.7 -
2.下列反應(yīng)屬于吸熱反應(yīng)且不屬于氧化還原反應(yīng)的是( )
A.灼熱的炭與二氧化碳反應(yīng) B.碳酸氫鈉與鹽酸反應(yīng) C.氯酸鉀固體受熱分解 D.生石灰與水反應(yīng) 組卷:3引用:2難度:0.5 -
3.下列物質(zhì)屬于弱電解質(zhì)的是( )
A.CH3COONa B.HClO C.SO2 D.氨水 組卷:11引用:2難度:0.7 -
4.下列溶液不一定顯中性的是( )
A.pH=6的蒸餾水 B.c(H+)= KwC.c(OH-)=c(H+)的溶液 D.水電離出的氫離子物質(zhì)的量濃度為10-7mol/L 組卷:37引用:3難度:0.8 -
5.反應(yīng)A(g)+3B(g)═2C(g)+D(g)在四種不同情況下的反應(yīng)速率如下,表示反應(yīng)速率最快的是( )
A.v(A)=0.015mol?L-1?s-1 B.v(B)=0.030mol?L-1?s-1 C.v(C)=1.2mol?L-1?min-1 D.v(D)=0.020mol?L-1?s-1 組卷:6引用:2難度:0.7 -
6.下列反應(yīng)不可能自發(fā)進(jìn)行的是( )
A.2O3(g)═3O2(g);△H<0 B.2CO(g)═2C(s)+O2(g);△H>0 C.N2(g)+3H2(g)═2NH3(g);△H<0 D.CaCO3(s)═CaO(s)+CO2(g);△H>0 組卷:139引用:21難度:0.9 -
7.下列關(guān)于化學(xué)反應(yīng)速率的說法正確的是( )
A.恒溫時(shí),增大壓強(qiáng),化學(xué)反應(yīng)速率一定加快 B.使用催化劑可增大活化分子百分?jǐn)?shù),化學(xué)反應(yīng)速率增大 C.增大反應(yīng)物濃度可增大活化分子的百分?jǐn)?shù),化學(xué)反應(yīng)速率增大 D.SO2的催化氧化為放熱反應(yīng),溫度升高,逆反應(yīng)速率增大,正反應(yīng)速率減小 組卷:15引用:2難度:0.5 -
8.下列關(guān)于能量變化的說法正確的是( )
A.P4(s,白磷)═4P(s,紅磷) ΔH<0,則白磷比紅磷穩(wěn)定 B.活化分子發(fā)生有效碰撞,吸收能量轉(zhuǎn)化為產(chǎn)物分子 C.“冰,水為之,而寒于水”說明相同質(zhì)量的水和冰相比較,水的能量高 D.反應(yīng)2H2O2═2H2O+O2↑,加入MnO2降低了反應(yīng)的活化能和焓變 組卷:19引用:2難度:0.8 -
9.下列電離方程式正確的是( )
A.NaHCO3═Na++H++CO32- B.Fe(OH)3═Fe3++3OH- C.H2CO3?2H++CO32- D.Ca(OH)2═Ca2++2OH- 組卷:65引用:2難度:0.6
二、非選擇題(本大題共4小題,共50分)
-
28.硫代硫酸鈉(Na2S2O3)是常見的分析試劑。實(shí)驗(yàn)室制備Na2S2O3溶液的裝置如圖(部分裝置省略,C中Na2SO3過量):
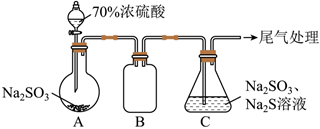
(1)裝置B的作用是。
(2)裝置C中的反應(yīng)分兩步,其中第一步反應(yīng)生成S單質(zhì),第二步反應(yīng)方程式為。
(3)工業(yè)廢水中常含有一定量氧化性較強(qiáng)的Cr2O72-,利用滴定原理測(cè)定Cr2O72-含量方法如下:
步驟Ⅰ:量取30.00mL廢水于錐形瓶中,加入適量稀硫酸酸化。
步驟Ⅱ:加入過量的碘化鉀溶液充分反應(yīng):Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O
步驟Ⅲ:向錐形瓶中滴入幾滴指示劑。用滴定管量取0.1000mol?L-1Na2S2O3溶液進(jìn)行滴定,數(shù)據(jù)記錄如下:(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
①步驟Ⅰ量取30.00mL廢水選擇的儀器是滴定次數(shù) 第一次 第二次 第三次 滴定前讀數(shù)(mL) 0.50 1.20 0.20 滴定后讀數(shù)(mL) 12.49 14.99 12.21 。
②步驟Ⅲ中滴加的指示劑為淀粉溶液。滴定達(dá)到終點(diǎn)的實(shí)驗(yàn)現(xiàn)象是。
③滴定前,有關(guān)滴定管的正確操作為:
檢漏→蒸餾水洗滌→(一系列操作)→記錄起始數(shù)據(jù)→開始滴定。該“一系列操作”順序?yàn)?(選出正確操作并按序排列)
a.調(diào)整滴定液液面至零刻度或零刻度以下
b.裝入滴定液至零刻度以上
c.烘干d.用滴定液潤洗2至3次
d.排除氣泡
④Cr2O72-的含量為g?L-1。
⑤以下操作會(huì)造成廢水中Cr2O72-含量測(cè)定值偏高的是。
A.滴定終點(diǎn)讀數(shù)時(shí),仰視滴定管的刻度
B.盛裝待測(cè)液的錐形瓶未用待測(cè)液潤洗
C.盛裝Na2S2O3溶液的滴定管尖端開始時(shí)有氣泡,滴定后氣泡消失
D.滴定過程中振蕩劇烈,使少量溶液濺出組卷:7引用:2難度:0.6 -
29.NOx是形成霧霾天氣的主要原因之一,全球空氣污染日趨嚴(yán)重,消除氮氧化物污染對(duì)建設(shè)宜居環(huán)境有重要意義。氮氧化物的處理常用NH3催化還原,反應(yīng)原理為:6NO(g)+4NH3(g)?6H2O(g)+5N2(g)ΔH
已知:N2(g)+O2(g)═2NO(g)ΔH1=+180.4kJ?mol-1
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)ΔH2=-905.8kJ?mol-1
(1)用NH3消除NO污染的反應(yīng)ΔH=kJ?mol-1,則該反應(yīng)自發(fā)進(jìn)行的條件是(填“高溫”、“低溫”或“任何溫度”)。
(2)下列措施可增大NO轉(zhuǎn)化率的是(填標(biāo)號(hào))。
A.升高溫度
B.將水蒸氣從體系中分離出去
C.保持體系壓強(qiáng)不變充入He
D.增大氨氣的濃度
(3)該反應(yīng)t1時(shí)到達(dá)平衡。在t2時(shí)刻保持恒容繼續(xù)充入一定量NO,t3時(shí)刻重新到達(dá)平衡,請(qǐng)?jiān)趫D中作出逆反應(yīng)速率在t2~t3變化的曲線。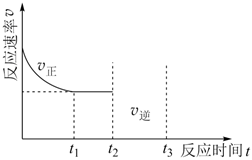
(4)一定溫度下,在2L恒容密閉容器中充入1.2molNO和0.9molNH3,10min時(shí)反應(yīng)達(dá)到平衡,此時(shí)NO的轉(zhuǎn)化率為50%,體系壓強(qiáng)為pMPa,該反應(yīng)的平衡常數(shù)Kp=Mpa(用含p的代數(shù)式表示,分壓p(B)=p?x(B),p為平衡總壓強(qiáng),x(B)為平衡系統(tǒng)中B的物質(zhì)的量分?jǐn)?shù))。
(5)不同溫度條件下,NH3與NO的物質(zhì)的量之比分別為4:1、3:1、1:3,反應(yīng)經(jīng)2秒得到NO脫除率曲線如圖所示。曲線a中NH3的起始濃度為8×10-5mol?L-1,B點(diǎn)NO的脫除速率為mol/(L?s),在AB所在的曲線上當(dāng)溫度高于900℃時(shí)NO脫除率明顯降低的原因是。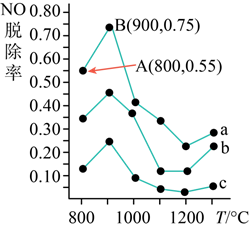 組卷:12引用:2難度:0.5
組卷:12引用:2難度:0.5


