2020年天津市津南區咸水沽二中高考化學模擬試卷
發布:2024/4/20 14:35:0
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.下列敘述正確的是( )
A.常溫下,相同濃度的溶液堿性比較:NaHCO3<Na2CO3 B.常溫下,往Na2CO3溶液中滴加稀鹽酸至中性時,溶質的主要成分有NaHCO3、NaCl C.加熱FeCl3溶液至蒸干,可得到純凈的FeCl3固體 D.常溫下,若FeCl3溶液中含有FeCl2可用NaOH溶液鑒別 組卷:127引用:3難度:0.7 -
2.以鉛蓄電池為外電源,Al作陽極、Pb作陰極,電解稀硫酸,使鋁表面的氧化膜增厚。
已知:鉛蓄電池中的總反應方程式為:Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l)放電充電
電解的化學方程式:2Al+3H2OAl2O3+3H2↑通電
對該電解過程,下列判斷錯誤的是( )A.電解池:溶液的pH減小 B.電解池:SO42-移向Al電極 C.鉛蓄電池:負極質量不變 D.鉛蓄電池:工作一段時間后,進行充電時鉛蓄電池的負極接電源的負極 組卷:54引用:2難度:0.7 -
3.下列有關化學反應原理判斷正確的是( )
A.若一定條件下,反應H2(g)+X2(g)?2HX(g)達平衡后,壓縮容器,則反應物濃度增大,平衡正向移動 B.已知水合肼(N2H4?H2O)是二元弱堿,能發生類似于多元酸的電離形式,則在水中它的第二步電離方程式為N2H5++H2O?N2H62++OH- C.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 D.在一定條件下的Na2CO3溶液,若升高溫度,則 減小c(HCO-3)c(CO2-3)組卷:9引用:2難度:0.5 -
4.NA表示阿伏加德羅常數,下列說法正確的是( )
A.7.8gNa2O2固體中離子總數為0.4NA B.1mol-OH(羥基)所含電子數為10NA C.1mol Fe與足量濃鹽酸反應轉移電子數為3NA D.常溫下,1L 0.1mol/L Na2S溶液中S2-數目小于0.1NA 組卷:132引用:4難度:0.8 -
5.根據已有知識判斷下列說法錯誤的是( )
A.為防止月餅等富脂食品因被氧化而變質,常在包裝袋中放入硅膠 B.汽車使用乙醇汽油與傳統汽油相比可以減少尾氣污染 C.浸泡過高錳酸鉀溶液的硅藻土與水果放在一起可以保鮮水果 D.雞蛋煮熟過程中蛋白質變性 組卷:110引用:2難度:0.8
二、解答題(共4小題,滿分64分)
-
 15.ClO2是一種優良的消毒劑,濃度過高時易發生分解,為了運輸和貯存便利常將其制成NaClO2固體,模擬工業上用過氧化氫法制備NaClO2固體的實驗裝置如圖所示。
15.ClO2是一種優良的消毒劑,濃度過高時易發生分解,為了運輸和貯存便利常將其制成NaClO2固體,模擬工業上用過氧化氫法制備NaClO2固體的實驗裝置如圖所示。
已知:ClO2熔點-59℃、沸點11℃、H2O2沸點150℃A中的化學方程式:2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O
(1)NaClO3放入儀器A中,儀器B中的藥品是(寫化學式)。如果儀器B改成分液漏斗,實驗過程中可能會出現的實驗現象。
(2)C裝置有明顯缺陷,請繪出合理的裝置圖(標明氣流方向)。
(3)向A裝置中通入空氣,其作用是趕出ClO2,然后通過C再到D中反應。通空氣不能過快的原因是,通空氣也不能過慢原因是。
(4)冰水浴冷卻的目的是。
a.降低NaClO2的溶解度
b.減少H2O2的分解
c.使ClO2變為液態
d.加快反應速率
(5)寫出D中發生反應的化學方程式,H2O2在反應起到作用。假設在反應中消耗掉H2O2ag則有mol電子轉移。組卷:88引用:2難度:0.5 -
16.治理大氣和水體污染對建設美麗家鄉,打造宜居環境具有重要意義。
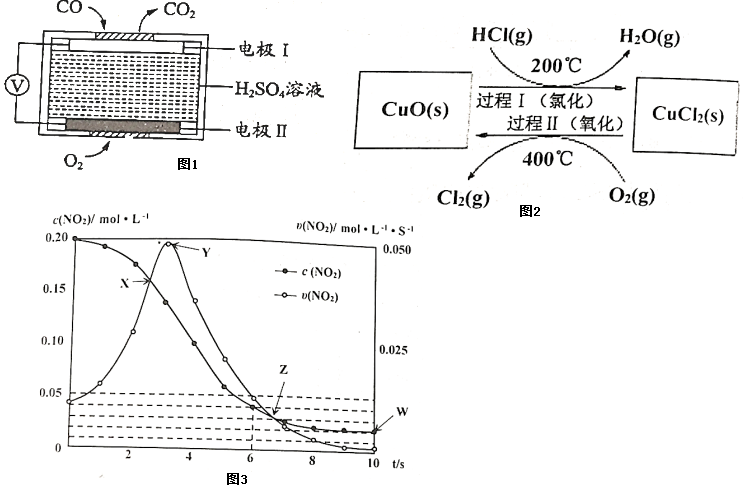
(1)CO泄漏會導致人體中毒,用于檢測CO的傳感器的工作原理如圖1所示:寫出電極Ⅰ上發生的反應式:工作一段時間后溶液中H2SO4的濃度(填“變大”、“變小”或“不變”)
(2)用O2氧化HCl制取Cl2,可提高效益,減少污染。
反應為:4HCl(g)+O22Cl2(g)+2H2O(g)△H,通過控制條件,分兩步循環進行,可使HCl轉化率接近100%,其原理如圖2所示:CuO/CuCl2
過程Ⅰ的反應為:2HCl(g)+CuO(s)?CuCl2(s)+H2O(g)△H1
過程Ⅱ反應的熱化學方程式(△H2用含有△H和△H1的代數式表示)。
(3)在溫度T0℃,容積為1L的絕熱容器中,充入0.2mol NO2,發生反應:2NO2(g)?N2O4(g)△H<0
,容器中NO2的相關量隨時間變化如圖3所示。
①反應到6s時,NO2的轉化率是。
②根據圖示,以下各點表示反應達到平衡狀態的是。
a.X
b.Y
c.Z
d.W
③0~3s內容器中NO2的反應速率增大,而3s后容器中NO2的反應速率減小了,原因是。
④此容器中反應達平衡時,溫度若為T1℃,此溫度下的平衡常數K=。
(4)工業上可用Na2SO3溶液吸收法處理SO2,25℃時用1mol?L-1的Na2SO3溶液吸收SO2,當溶液pH=7時,溶液中各離子濃度的大小關系為:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)。(已知25℃時:H2SO3的電離常數Ka1=1.3×10-2,Ka2=6.2×10-8)請結合所學理論通過計算說明c(HSO3-)>c(SO32-)的原因。組卷:69引用:3難度:0.5


