2021年北京市延慶區高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.2020年,北京市延慶區在生活垃圾分類促進源頭減量工作中表現突出。下列垃圾分類不合理的是( )
A B C D 垃圾 廢棄的書本 橘子皮、果皮菜葉 廢電池 礦泉水瓶 垃圾
分類



A.A B.B C.C D.D 組卷:22引用:3難度:0.6 -
2.下列變化或應用中,與氧化還原反應無關的是( )
A.飽和(NH4)2SO4溶液中加入少量雞蛋清變渾濁 B.油酸甘油酯通過氫化反應變為硬脂酸甘油酯 C.切開土豆、蘋果,在空氣中放置一段時間后變色 D.食用補鐵劑(含琥珀酸亞鐵)時常與維生素C同服 組卷:20引用:2難度:0.7 -
3.已知:34Se(硒)與S為同主族元素。下列說法不正確的是( )
A.Se原子核外最外層有6個電子 B.熱穩定性:H2Se<H2S C.H2Se的電子式是H:Se:H D.非金屬性:Se<Cl 組卷:44引用:2難度:0.5 -
4.鹽酸與下列物質反應(可加熱)時,HCl表現出還原性的是( )
A.Zn B.MnO2 C.Na2O D.CaCO3 組卷:12引用:1難度:0.7 -
5.淀粉在人體內的變化過程如圖:

下列說法不正確的是( )A.淀粉屬于天然有機高分子 B.n>m C.②的反應生成的二糖是蔗糖 D.④的反應是氧化反應 組卷:26引用:3難度:0.7 -
6.下列指定反應的離子方程式不正確的是( )
A.用過量NaOH溶液脫除煙氣中的SO2:OH-+SO2=HSO3- B.氨水與稀鹽酸反應:NH3?H2O+H+=NH4++H2O C.向鐵制器具上電鍍銅,陰極的電極反應為:Cu2++2e-=Cu D.飽和Na2CO3溶液與CaSO4固體反應:CO32-+CaSO4(s)?CaCO3(s)+SO42-(aq) 組卷:24引用:1難度:0.7
二、非選擇題本部分共5題,共58分。
-
18.MnO2是重要的化工原料,由軟錳礦制備MnO2的一種工藝流程如圖:

資料:①軟錳礦的主要成分為MnO2,主要雜質有Al2O3和SiO2
②金屬離子沉淀的pH
(1)步驟 I,軟錳礦需研磨。目的是Fe3+ Al3+ Mn2+ Fe2+ 開始沉淀時 1.5 3.4 5.8 6.3 完全沉淀時 2.8 4.7 7.8 8.3 。
(2)寫出步驟II溶出Mn2+發生反應的離子方程式。
(3)步驟II中若用鐵屑替代FeSO4會更節省原料,原因是。
(4)寫出步驟 III純化過程所加試劑的目的。
(5)IV電解。Mn2+純化液經電解得MnO2。生成MnO2的電極反應式是。
(6)測定產品純度。向m g產品中依次加入足量n gNa2C2O4和足量稀H2SO4,加熱至充分反應。再用a mol?L-1KMnO4溶液滴定剩余Na2C2O4至終點,消耗KMnO4溶液的體積為b L,產品純度為(用質量分數表示)。(已知:MnO2及MnO4-均被還原為Mn2+。相對分子質量:MnO2-87;Na2C2O4-134)組卷:21引用:1難度:0.5 -
 19.某實驗小組同學探究“氧化劑對KSCN檢驗Fe2+的影響”,進行如下實驗:
19.某實驗小組同學探究“氧化劑對KSCN檢驗Fe2+的影響”,進行如下實驗:
已知:Ba2+與SCN-可在溶液中大量共存;SCN-易被氧化為實驗 試劑 現象 試管 滴管(各1滴) 
2 mL 0.5 mol?L-1 FeSO4溶液與1滴0.5 mol?L-1 KSCN溶液 飽和氯水 Ⅰ.溶液立即變為淺紅色 稀硝酸 Ⅱ.溶液立即變為紅色 5% H2O2溶液 Ⅲ.溶液立即變為深紅色,無氣體產生 SO2-4
(1)向2 mL 0.5 mol?L-1FeSO4溶液中滴加1滴0.5 mol?L-1 KSCN溶液,無明顯現象,通入O2,無明顯變化。
①該實驗的目的是;
②用離子方程式表示Ⅰ中出現淺紅色的原因:、。
(2)對Ⅰ中溶液為淺紅色的原因,甲同學提出以下假設。
①假設1:加入氯水的量少,生成的Fe3+濃度低
②假設2:氯水氧化性強,氧化了部分SCN-
繼續以下實驗:
i.取Ⅰ中淺紅色溶液,(填寫實驗操作),溶液淺紅色消失,從而排除了假設1
ⅱ.向2 mL水中滴加1滴0.5 mol?L-1 KSCN溶液,滴加1滴飽和氯水,加入試劑a(填寫化學式),產生白色沉淀。
(3)為驗證實驗Ⅰ、Ⅱ、Ⅲ.中硫氰化鉀的被氧化程度,進行以下探究實驗:
已知:溶解度:AgSCN(白色)<AgCl<Ag2SO4
分別向下表4支試管溶液中,繼續滴加一定濃度的AgNO3溶液至溶液紅色恰好褪去,記錄消耗AgNO3溶液的體積。實驗記錄如下:
①用化學用語表示滴加AgNO3后溶液紅色褪去的原因實驗 試管 消耗AgNO3溶液的體積/mL IV 實驗Ⅰ中溶液 1.52 V 實驗Ⅱ中溶液 1.60 VI 實驗Ⅲ中溶液 1.84 VII 2 mL水與1滴Fe2(SO4)3溶液和1滴0.5 mol?L-1 KSCN溶液 2.40 。
②由Ⅳ~Ⅶ可以得出的結論是。
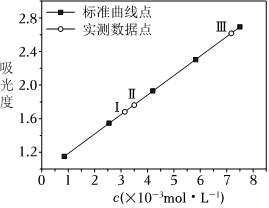
(4)借助紫外-可見分光光度計可以測定Fe3+濃度。
已知:體系的吸光度與Fe3+濃度呈線性正相關。
丙同學利用上述方法測定了實驗Ⅰ、Ⅱ、Ⅲ體系的吸光度,數據如圖所示。
由上述實驗可知,Ⅰ、Ⅱ、Ⅲ中溶液顏色分別呈現淺紅色、紅色和深紅色的原因為。組卷:40引用:4難度:0.6


