2023年北京師大附屬實驗中學高考化學零模試卷
發布:2024/4/20 14:35:0
一、本部分共14題,每題3分,共42分.在每題列出的四個選項中,選出最符合題目
-
1.下列化學用語或圖示表達正確的是( )
A.基態Cr的價層電子軌道表示式: 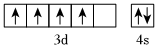
B.2-丁烯的鍵線式: 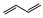
C.37Cl-的結構示意圖: 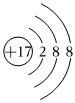
D.過氧化氫的電子式: 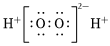 組卷:43引用:2難度:0.7
組卷:43引用:2難度:0.7 -
2.下列性質的比較,不能用元素周期律解釋的是( )
A.酸性:HClO4>H2SO3>H2SiO3 B.堿性:KOH>NaOH>LiOH C.熱穩定性:H2O>H2S>PH3 D.非金屬性:F>O>N 組卷:575引用:19難度:0.6 -
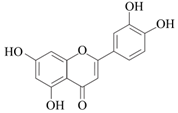 3.木犀草素有鎮咳化痰的作用,其結構簡式如圖。下列說法不正確的是( )
3.木犀草素有鎮咳化痰的作用,其結構簡式如圖。下列說法不正確的是( )A.分子中有3種含氧官能團 B.分子中碳原子均為sp2雜化 C.能與NaHCO3溶液反應,產生氣泡 D.能與Br2發生取代反應和加成反應 組卷:82引用:3難度:0.6 -
4.下列物質用途或變化過程與氧化還原反應無關的是( )
A.FeSO4補血劑與維生素C配合使用效果更佳 B.明礬用作污水處理劑 C.將SO2通入到Ba(NO3)2溶液中,生成白色沉淀 D.銅絲加熱后,伸入無水乙醇中 組卷:32引用:3難度:0.8 -
5.能正確表示下列反應的離子方程式為( )
A.硫化亞鐵和過量硝酸混合:FeS+2H+=Fe2++H2S↑ B.向FeI2溶液中通入等物質的量的Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- C.Na2CO3溶液中通入少量SO2; +2SO2+H2O=2CO2-3+CO2HSO-3D.等物質的量濃度的Ba(OH)2和NH4HSO4溶液以體積比1:2混合:Ba2++2OH-+2H++ =BaSO4↓+2H2OSO2-4組卷:99引用:3難度:0.5 -
6.用下列裝置進行實驗,儀器選擇正確且能達到實驗目的的是( )
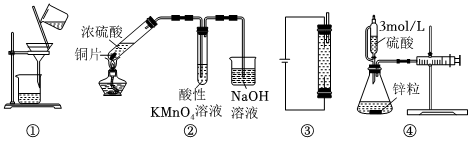
A.圖①除去Fe(OH)3膠體中的Na+、Cl- B.圖②可證明SO2有漂白性 C.圖③用石墨作電極電解飽和食鹽水生產NaClO D.圖④測量生成氫氣的體積 組卷:89引用:3難度:0.5
二、解答題(共5小題,滿分23分)
-
18.MnO2是重要化工原料,由軟錳礦制備MnO2的一種工藝流程如圖。
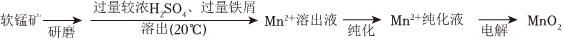
資料:
①軟錳礦的主要成分為MnO2,主要雜質有Al2O3和SiO2
②金屬離子沉淀的pH
③該工藝條件下,MnO2與H2SO4不反應。Fe3+ Al3+ Mn2+ Fe2+ 開始沉淀時 1.5 3.4 5.8 6.3 完全沉淀時 2.8 4.7 7.8 8.3
(1)溶出
①溶出前,軟錳礦需研磨。目的是。
②溶出時,Fe的氧化過程及得到Mn2+的主要途徑如圖所示。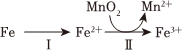
ⅰ.Ⅱ是從軟錳礦中溶出Mn2+的主要反應,反應的離子方程式是
ⅱ.若Fe2+全部來自于反應Fe+2H+═Fe2++H2↑,完全溶出Mn2+所需Fe與MnO2的物質的量比值為2.而實際比值(0.9)小于2,原因是。
(2)純化
已知:MnO2的氧化性與溶液pH有關。純化時先加入MnO2,后加入NH3?H2O,調溶液pH≈5,說明試劑加入順序及調節pH的原因:。
(3)電解:Mn2+純化液經電解得MnO2.生成MnO2的電極反應式是。
(4)產品純度測定
向ag產品中依次加入足量bg Na2C2O4和足量稀H2SO4,加熱至充分反應,再用cmol?L-1KMnO4溶液滴定剩余Na2C2O4至終點,消耗KMnO4溶液的體積為dL.(已知:MnO2及均被還原為Mn2+.相對分子質量:MnO286.94;Na2C2O4134.0)產品純度為MnO-4。(用質量分數表示)組卷:755引用:6難度:0.2 -
19.在處理NO廢氣的過程中,催化劑[Co(NH3)6]2+會逐漸失活變為[Co(NH3)6]3+。某小組為解決這一問題,實驗研究
和+2Co之間的相互轉化。+3Co
資料:ⅰ.Ksp[Co(OH)2]=5.9×10-15 Ksp[Co(OH)3]=1.6×10-44
ⅱ.Co2++6NH3?[Co(NH3)6]2+K1=1.3×105
Co2++6NH3?[Co(NH3)6]3+K2=2×1035
ⅲ.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性條件下均能生成NH+4
(1)探究的還原性+2Co
實驗Ⅰ粉紅色的CoCl2溶液或CoSO4溶液在空氣中久置,無明顯變化。
實驗Ⅱ向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,無明顯變化。
實驗Ⅲ按如圖裝置進行實驗,觀察到電壓表指針偏轉。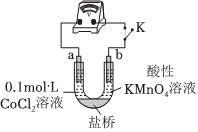
①甲同學根據實驗Ⅲ得出結論:Co2+可以被酸性KMnO4溶液氧化。乙同學補充實驗Ⅳ,(補全實驗操作及現象),否定了該觀點。
②探究堿性條件下的還原性,進行實驗。實驗Ⅴ:+2Co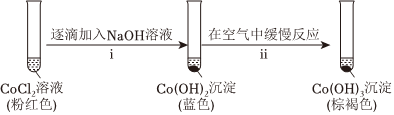
ⅱ中反應的化學方程式是。
③根據氧化還原反應規律解釋還原性Co(OH)2>Co2+:Co2+-e-═Co3+在堿性條件下,OH-與Co2+、Co3+反應,使c(Co2+)和c(Co3+)均降低,但降低的程度更大,還原劑的還原性增強。
(2)探究Co的氧化性
①根據實驗Ⅲ和Ⅳ推測氧化性:Co3+>Cl2,設計實驗證明:向Ⅴ中得到的棕褐色沉淀中,(補全實驗操作及現象),反應的離子方程式是。
②向Ⅴ中得到的棕褐色沉淀中,滴加H2SO4溶液,加入催化劑,產生無色氣泡,該氣體是。
(3)催化劑[Co(NH3)6]2+的失活與再生
①結合數據解釋[Co(NH3)6]2+能被氧化為[Co(NH3)6]3+而失活的原因:。
②根據以上實驗,設計物質轉化流程圖實現[Co(NH3)6]2+的再生:。
流程圖示例:CoCoCl2Cl2Co(OH)2NaOH組卷:49引用:4難度:0.4


