2020-2021學(xué)年寧夏大學(xué)附中高二(下)第一次月考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題為單項(xiàng)選擇題,每題2分,共計(jì)60分)
-
1.下列關(guān)于反應(yīng)熱和焓變的說(shuō)法正確的是( )
A.反應(yīng)熱就是反應(yīng)中放出的熱量 B.當(dāng)反應(yīng)放熱時(shí)△H>0,反應(yīng)吸熱時(shí)△H<0 C.一個(gè)化學(xué)反應(yīng)中,當(dāng)反應(yīng)物的總能量大于生成物的總能量時(shí),反應(yīng)放熱,△H為“-” D.一個(gè)化學(xué)反應(yīng)中,生成物總鍵能大于反應(yīng)物的總鍵能時(shí),反應(yīng)吸熱,△H為“+” 組卷:44引用:5難度:0.9 -
2.下列過(guò)程中△H小于零的是( )
A.氯酸鉀分解制氧氣 B.氯化銨受熱分解 C.氫氣還原氧化銅 D.實(shí)驗(yàn)室用鋅和稀硫酸反應(yīng)制氫氣 組卷:10引用:3難度:0.9 -
 3.根據(jù)如圖提供的信息,下列所得結(jié)論不正確的是( )
3.根據(jù)如圖提供的信息,下列所得結(jié)論不正確的是( )A.該反應(yīng)為吸熱反應(yīng) B.該反應(yīng)一定有能量轉(zhuǎn)化成了化學(xué)能 C.反應(yīng)物比反應(yīng)產(chǎn)物穩(wěn)定 D.因?yàn)榉磻?yīng)物的總能量低于反應(yīng)產(chǎn)物的總能量,所以該反應(yīng)需要加熱才能發(fā)生 組卷:16引用:1難度:0.6 -
4.已知:H2(g)+
O2(g)=H2O(g)△H=-242kJ/mol,斷開(kāi)1 mol O=O鍵和1 molH-O鍵所吸收的能量分別為496 kJ和463kJ,則斷開(kāi)1 mol H-H鍵所吸收的能量為( )12A.920 kJ B.557 kJ C.436 kJ D.188 kJ 組卷:23引用:4難度:0.5 -
5.下列熱化學(xué)方程式書(shū)寫(xiě)正確的是( )
A.2SO2+O2 2SO3△H=-196.6kJ?mol-1V2O5500℃B.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1 C.H2(g)+Cl2(g)═2HCl(g)△H=-183kJ D.C(s)+O2(g)═CO2(g)△H=+393.5kJ?mol-1 組卷:14引用:4難度:0.5 -
6.沼氣是一種能源,它主要是CH4,常溫下0.5mol CH4完全燃燒生成CO2和H2O時(shí),放出445kJ的熱量,則下列熱化學(xué)方程式中正確的是( )
A.2 CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890kJ/mol B.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+890kJ/mol C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol D.0.5CH4(g)+O2(g)=0.5CO2(g)+H2O(l);△H=-890kJ/mol 組卷:6引用:2難度:0.9 -
7.已知強(qiáng)酸與強(qiáng)堿的稀溶液發(fā)生中和反應(yīng)的熱化學(xué)方程式為H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,向0.1L 0.2mol?L-1的NaOH溶液中加入下列物質(zhì):①稀醋酸;②濃硫酸;③稀鹽酸,恰好完全反應(yīng)。則其焓變△H1、△H2、△H3的關(guān)系是( )
A.△H1>△H2>△H3 B.△H1>△H3>△H2 C.△H1=△H3>△H2 D.△H1<△H3<△H2 組卷:163引用:5難度:0.5 -
 8.將V1 mL 1.0mol/L HCl溶液和V2 mL未知濃度的NaOH溶液混合均勻后測(cè)量并記錄溶液溫度,結(jié)果如圖所示(實(shí)驗(yàn)中始終保持V1+V2=50mL).下列敘述正確的是( )
8.將V1 mL 1.0mol/L HCl溶液和V2 mL未知濃度的NaOH溶液混合均勻后測(cè)量并記錄溶液溫度,結(jié)果如圖所示(實(shí)驗(yàn)中始終保持V1+V2=50mL).下列敘述正確的是( )A.做該實(shí)驗(yàn)時(shí)環(huán)境溫度為22℃ B.該實(shí)驗(yàn)表明化學(xué)能可以轉(zhuǎn)化為熱能 C.NaOH溶液的濃度約是1.00 mol/L D.該實(shí)驗(yàn)表明有水生成的反應(yīng)都是放熱反應(yīng) 組卷:182引用:46難度:0.7 -
9.下列熱化學(xué)方程式或離子方程式中,正確的是( )
A.甲烷的燃燒熱為890.3kJ?mol-1,則甲烷燃燒的熱化學(xué)方程式可表示為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 B.CO(g)的燃燒熱△H=-283.0kJ?mol-1,則2CO2(g)═2CO(g)+O2(g)的反應(yīng)熱△H=2×(+283.0kJ?mol-1) C.HCl(aq)和NaOH(aq)反應(yīng)的中和熱△H=-57.3kJ?mol-1,則稀H2SO4(aq)和Ca(OH)2(aq)反應(yīng)的中和熱△H=2×(-57.3kJ?mol-1) D.500℃、30MPa下,將0.5mol N2和1.5mol H2置于密閉的容器中充分反應(yīng)生成NH3(g),放熱19.3kJ,其熱化學(xué)方程式為N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 組卷:11引用:1難度:0.5 -
10.乙醇的燃燒熱為ΔH1,甲醇的燃燒熱為ΔH2,且ΔH1<ΔH2,若乙醇和甲醇的混合物1mol完全燃燒,反應(yīng)熱為ΔH3,則乙醇和甲醇的物質(zhì)的量之比為( )
A. △H3-△H2△H3-△H1B. △H2-△H3△H3-△H1C. △H2-△H3△H1-△H3D. △H3-△H1△H2-△H3組卷:161引用:12難度:0.9 -
11.已知:(1)Zn(s)+
O2(g)═ZnO(s)△H=-348.3kJ?mol-1,12
(2)2Ag(s)+O2(g)═Ag2O(s)△H=-31.0kJ?mol-1,12
則Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )A.-379.3kJ?mol-1 B.-317.3kJ?mol-1 C.-332.8kJ?mol-1 D.317.3kJ?mol-1 組卷:382引用:38難度:0.9
二、填空題(本題共4題,共計(jì)40分)
-
33.以下是關(guān)于“外界因素對(duì)化學(xué)平衡移動(dòng)影響的實(shí)驗(yàn)研究”的課題,回答問(wèn)題:
(1)研究的思路與方法.
①研究對(duì)象的選擇,現(xiàn)有以下可逆反應(yīng):
A.2NO2(g)?N2O4(g)△H<0
B.FeCl3+3KSCN?Fe(SCN)3+3KCl
其中,A適合于研究對(duì)平衡的影響,B適合于研究對(duì)平衡的影響.(填字母:a.濃度、b.溫度、c.壓強(qiáng))
②研究方法:采用控制其他因素不變,改變其中一個(gè)因素的方法,并進(jìn)行對(duì)比實(shí)驗(yàn).
(2)單一因素對(duì)化學(xué)平衡移動(dòng)影響的實(shí)驗(yàn)研究.
①濃度:將FeCl3與KSCN反應(yīng)后所得的混合液分為三等份,分別加入濃FeCl3溶液、濃KSCN溶液和NaOH固體,觀察現(xiàn)象.
現(xiàn)象:加入濃FeCl3溶液后的混合溶液紅色;加入濃KSCN溶液后的混合溶液紅色;加入NaOH固體后,混合溶液紅色.
②溫度:將密封并相互連通的盛有NO2的兩個(gè)玻璃球,一個(gè)放入熱水中,另一個(gè)放入冷水中.
現(xiàn)象:放入熱水中的球內(nèi)紅棕色;放入冷水中的球內(nèi)紅棕色.
(3)綜合(2)中研究結(jié)果,請(qǐng)總結(jié)外界因素對(duì)化學(xué)平衡的影響規(guī)律.組卷:254引用:4難度:0.3 -
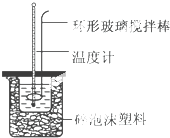 34.實(shí)驗(yàn)室用50mL 0.50mol?L-1鹽酸、50mL 0.55mol?L-1 NaOH溶液和如圖所示裝置,進(jìn)行測(cè)定中和熱的實(shí)驗(yàn),得到下表中的數(shù)據(jù)
34.實(shí)驗(yàn)室用50mL 0.50mol?L-1鹽酸、50mL 0.55mol?L-1 NaOH溶液和如圖所示裝置,進(jìn)行測(cè)定中和熱的實(shí)驗(yàn),得到下表中的數(shù)據(jù)
完成下列問(wèn)題實(shí)驗(yàn)次數(shù) 起始溫度t1/℃ 終止溫
度t2/℃鹽酸 NaOH溶液 1 20.2 20.3 23.7 2 20.3 20.5 23.8 3 21.5 21.6 24.9
(1)實(shí)驗(yàn)時(shí)不能用銅絲攪拌棒代替環(huán)形玻璃攪拌棒的理由是。
(2)在操作正確的前提下,提高中和熱測(cè)定準(zhǔn)確性的關(guān)鍵是。
(3)根據(jù)上表中所測(cè)數(shù)據(jù)進(jìn)行計(jì)算,則該實(shí)驗(yàn)測(cè)得的中和熱△H=[鹽酸和NaOH溶液的密度按1g?cm-3計(jì)算,反應(yīng)后混合溶液的比熱容(c)按4.18J?(g?℃)-1計(jì)算].如果用0.5mol/L的鹽酸與NaOH固體進(jìn)行實(shí)驗(yàn),則實(shí)驗(yàn)中測(cè)得的“中和熱”數(shù)值將(填“偏大”、“偏小”或“不變”)。
(4)若某同學(xué)利用上述裝置做實(shí)驗(yàn),有些操作不規(guī)范,造成測(cè)得中和熱的數(shù)值偏低,請(qǐng)你分析可能的原因是。
A.測(cè)量鹽酸的溫度后,溫度計(jì)沒(méi)有用水沖洗干凈
B.把量筒中的氫氧化鈉溶液倒入小燒杯時(shí)動(dòng)作遲緩
C.做本實(shí)驗(yàn)的當(dāng)天室溫較高
D.在量取鹽酸時(shí)仰視讀數(shù)
E.大燒杯的蓋板中間小孔太大。組卷:42引用:2難度:0.5


