2019-2020學年安徽省安慶市樅陽縣浮山中學高二(下)開學化學試卷
發布:2024/11/26 15:0:2
一、選擇題
-
1.為解決日益加劇的溫室效應等問題,科學家正在研究建立如圖所示的二氧化碳新循環體系:
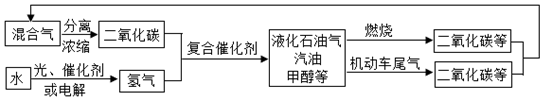
上述關系圖能反映的化學觀點或化學思想有( )
①化學變化中元素種類是不變的;②燃燒時化學能可以轉化為熱能和光能;
③光能或電能可以轉化為化學能;④無機物和有機物可以相互轉化;
⑤二氧化碳可成為一種重要的資源。A.①②③④ B.①②③⑤ C.①②④⑤ D.①②③④⑤ 組卷:25引用:4難度:0.6 -
2.有關熱化學方程式書寫與對應表述均正確的是( )
A.稀硫酸與0.1 mol/L NaOH溶液反應:H+(aq)+OH-(aq)=H2O(l)△H=+57.3 kJ?mol-1 B.在101KPa下氫氣的燃燒熱△H=-285.5 kJ?mol-1,則水分解的熱化學方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ?mol-1 C.已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,則可知C的燃燒熱大于110.5 kJ?mol-1 D.2N2O5(g)?4NO2(g)+O2(g)△H>0 反應為熵增反應,任何溫度下能自發進行 組卷:14引用:3難度:0.9 -
3.在容積一定的密閉容器中,置入一定量的一氧化氮和足量碳發生化學反應:C (s)+2NO(g)?CO2(g)+N2(g),平衡時c (NO)與溫度T的關系如圖所示,則下列說法正確的是( )
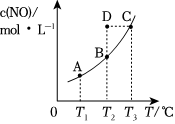
A.該反應的△H>0 B.若該反應在T1、T2時的平衡常數分別為K1、K2,則K1<K2 C.在T2時,若反應體系處于狀態D,則此時v正>v逆 D.若狀態B、C、D的壓強分別為PB、PC、PD,則 PC=PD>PB 組卷:157引用:19難度:0.7 -
4.根據下列圖示所得出的結論一定錯誤的是( )

A.圖甲表示酶催化反應的反應速率隨反應溫度的變化 B.圖乙表示向 Ba(OH)2 溶液中滴加稀硫酸至過量的過程中溶液導電性的變化 C.圖丙表示用 0.1000 mol?L-1 NaOH 溶液滴定 20.00 mL 0.1000 mol?L-1 醋酸的滴定曲線 D.圖丁表示相同溫度下,向等體積 pH=10 的氫氧化鈉溶液和氨水中分別加水稀釋時 pH 的變化曲線,其中 a 表示氨水稀釋時 pH 的變化曲線 組卷:57引用:3難度:0.7 -
5.在恒容密閉容器中,將10 mol CO和一定量的H2S混合加熱并達到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=1,平衡后CO物質的量為8 mol.下列說法正確的是( )
A.CO.H2S的轉化率之比為1:1 B.達平衡后H2S的體積分數為4% C.升高溫度,COS濃度減小,表明該反應是吸熱反應 D.恒溫下向平衡體系中再加入CO.H2S.COS.H2各1 mol,平衡不移動 組卷:10引用:3難度:0.6 -
6.在密閉容器中,反應X2(g)+Y2(g)?2XY(g)△H<0,達到甲平衡。在僅改變某一條件后,達到乙平衡,圖中對此過程的分析正確的是( )
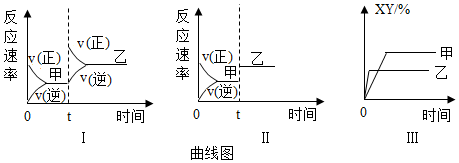
A.圖I是加入適當催化劑的變化情況 B.圖Ⅱ是擴大容器體積的變化情況 C.圖Ⅲ是增大壓強的變化情況 D.圖Ⅲ是升高溫度的變化情況 組卷:198引用:41難度:0.5 -
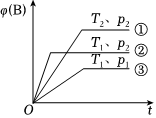 7.已知某可逆反應mA(g)+nB(g)?pC(g)在密閉容器中進行,如圖表示在不同反應時間t時,溫度T和壓強p與反應物B在混合氣體中的體積分數[φ(B)]的關系曲線,由曲線分析,下列判斷正確的是( )
7.已知某可逆反應mA(g)+nB(g)?pC(g)在密閉容器中進行,如圖表示在不同反應時間t時,溫度T和壓強p與反應物B在混合氣體中的體積分數[φ(B)]的關系曲線,由曲線分析,下列判斷正確的是( )A.T1<T2,p1>p2,m+n>p,放熱反應 B.T1>T2,p1<p2,m+n>p,吸熱反應 C.T1<T2,p1>p2,m+n<p,放熱反應 D.T1>T2,p1<p2,m+n<p,吸熱反應 組卷:277引用:25難度:0.7 -
8.在一固定容積的密閉容器中,充入2mol A和1mol B發生如下反應:2A(g)+B(g)?xC(g),達到平衡后,C的體積分數為w%;若維持容器體積和溫度不變,以0.6mol A、0.3mol B和1.4mol C為起始物質,達到平衡后,C的體積分數也為w%,則x的值為( )
A.5 B.4 C.3 D.1 組卷:177引用:4難度:0.7
二、非選擇題
-
23.結合下表回答下列問題(均為常溫下的數據):
請回答下列問題:酸 電離常數(Ka) 酸 電離常數(Ka) 酸 電離常數(Ka) 酸 電離常數(Ka) CH3COOH 1.8×10-5 H2CO3 K1=4.4×10-7 H2C2O4 K2=5.4×10-2 H2S K1=1.3×10-7 HClO 3×10-8 K2=4.7×10-11 K2=5.4×10-5 K2=7.1×10-15
(1)同濃度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中結合H+的能力最弱的是。
(2)0.1mol/L的H2C2O4溶液與0.1mol/L的KOH的溶液等體積混合后所得溶液呈酸性,該溶液中各離子濃度由大到小的順序為。
(3)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(ClO-)][c(K+)-c(CH3COO-)](填“>”、“<”或“=”)。
(4)向0.1mol/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH):c(CH3COO-)=5:9,此時溶液pH=。組卷:2引用:3難度:0.6 -
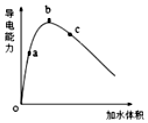 24.某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗:
24.某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗:
(1)取冰醋酸配制250mL 0.4 mol?L-1的醋酸溶液,用0.4 mol?L-1的醋酸溶液稀釋成所需濃度的溶液,再用NaOH標準溶液對所配醋酸溶液的濃度進行標定。
回答下列問題:
①將一定質量的冰醋酸加水稀釋過程中,溶液的導電能力變化如圖所示。則稀釋過程中溶液的pH由大到小的順序(填字母)。
②配制250mL 0.4 mol?L-1 醋酸溶液時需要用到的玻璃儀器有量筒、燒杯、玻璃棒、膠頭滴管和。
③為標定該醋酸溶液的準確濃度,用0.2000 mol?L-1的NaOH溶液對20.00mL醋酸溶液進行滴定,幾次滴定消耗NaOH溶液的體積如表:
該醋酸溶液的準確濃度為實驗序號 1 2 3 4 消耗NaOH溶液的體積(mL) 20.05 20.00 18.80 19.95 (保留小數點后四位),上述標定過程中,造成測定結果偏高的原因可能是(多選、錯選不得分)。
a.未用標準液潤洗堿式滴定管
b.滴定終點讀數時,俯視滴定管的刻度,其它操作均正確
c.盛裝未知液的錐形瓶用蒸餾水洗過,未用待測液潤洗
d.滴定到終點讀數時發現滴定管尖嘴處懸掛一滴溶液
(2)該小組同學探究濃度對醋酸電離程度的影響時,用pH計測定25℃時不同濃度的醋酸的pH,其結果如表:
①根據表中數據,可以得出醋酸是弱電解質的結論,你認為得出此結論的依據是醋酸濃度( mol?L-1) 0.0010 0.0100 0.0200 0.1000 0.2000 pH 3.88 3.38 3.23 2.88 2.73 。
②簡述用pH試紙測 0.1mol?L-1 醋酸溶液pH的方法。
③利用水解理論設計實驗證明醋酸的酸性比碳酸的強:。組卷:8引用:1難度:0.4


