人教版(2019)選擇性必修1《化學反應原理綜合》2017年單元測試卷(浙江省紹興市魯迅中學高二)
發布:2024/4/20 14:35:0
一、解答題(共4小題,滿分0分)
-
1.由某精礦石(MCO3?ZCO3)可以制備單質M,制備過程中排放出的二氧化碳可以作為原料制備甲醇.取該礦石樣品1.84g,高溫灼燒至恒重,得到0.96g僅含兩種金屬氧化物的固體,其中m(M):m(Z)=3:5.請回答:
(1)該礦石的化學式為.
(2)①以該礦石灼燒后的固體產物為原料,真空高溫條件下用單質硅還原,僅得到單質M和一種含氧酸鹽(只含Z、Si和O,且Z和Si的物質的量之比為2:1).寫出該反應的化學方程式:.
②單質M還可以通過電解熔融MCl2得到.不能用電解MCl2溶液的方法制備M的理由是.
(3)一定條件下,由CO2和H2制備甲醇的過程中含有下列反應:
反應1:CO2(g)+H2(g)?CO(g)+H2O(g)△H1
反應2:CO(g)+2H2(g)?CH3OH(g)△H2
反應3:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
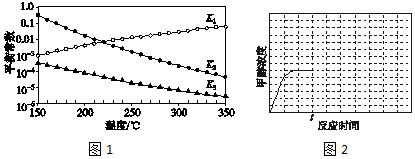
其對應的平衡常數分別為K1、K2、K2,它們隨溫度變化的曲線如圖1所示.
則△H2(填“大于”“小于”或“等于”)△H3,理由是.
(4)在溫度為T1時,使體積比為3:1的H2和CO2在體積恒定的密閉容器內進行反應.T1溫度下甲醇濃度隨時間變化曲線如圖2所示;不改變其他條件,假定t時刻迅速降溫到T2,一段時間后體系重新達到平衡.試在圖中畫出t時刻后甲醇濃度隨時間變化至平衡的示意曲線.組卷:104引用:2難度:0.5
一、解答題(共4小題,滿分0分)
-
3.由合成氣制備乙醇一般有兩種方法:
(1)直接合成法
①2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H1
②2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H2=-253.6kJ?mol-1
(2)間接合成法
合成氣反應生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氫得到乙醇.其生產流程如圖所示: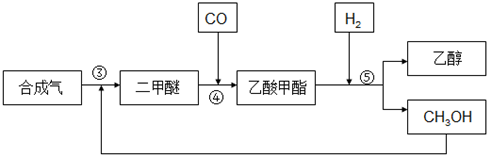
③3CO(g)+3H2(g)?CH3OCH3(g)+CO2△H3=-260.2kJ?mol-1
④CH3OCH3(g)+CO(g)?CH3COOCH3(g)
回答下列問題:
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1時,測得不同溫度時反應①中各物質的平衡組成如圖1所示: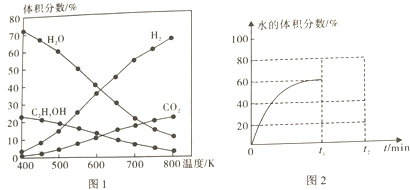
①反應①的△H10,△S0.(填“>”、“<”或“=”)
②已知CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ?mol-1,則△H1=.
③500K時,反應達到平衡后,在t1min時升溫到600K,反應在t2min重新達到平衡,請在圖2中畫出體系中水的體積分數在t1min后的變化曲線.
(2)對反應③處于化學平衡狀態時的描述,正確的是.(填字母).
A.CO的含量保持不變 B.容器中CH3OCH3濃度與CO2濃度相等
C.3V正(CO)=V正(CH3OCH3) D.體系的溫度保持不變
(3)間接合成法中將甲醇(CH3OH)循環使用的目的是.
(4)在2Mpa、T℃時1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氫氣,發生反應⑤,經t min后反應達到平衡,測得乙酸甲酯的轉化率為75%.則氫氣的反應速率v(H2)=,平衡常數K=.組卷:51引用:2難度:0.1 -
4.工業制硫酸,利用催化氧化反應將SO2轉化為SO3是一個關鍵步驟.請回答:
(1)某溫度下,SO2(g)+O2(g)?SO3(g);△H=-98kJ?mol-1.開始時在100L的密閉容器中加入4.0molSO2(g)和10.0molO2(g),當反應達到平衡時共放出熱量196kJ,該溫度下平衡常數K=12.
(2)一定條件下,向一帶活塞的密閉容器中充入2molSO2和1molO2,發生下列反應:
2SO2(g)+O2(g)?2SO3(g),達到平衡后改變下述條件,SO2、O2、SO3氣體平衡濃度都比原來增大的是(填字母).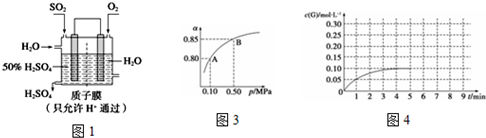
A.保持溫度和容器體積不變,充入2molSO3
B.保持溫度和容器體積不變,充入2molN2
C.保持溫度和容器體積不變,充入0.5molSO2和0.25molO2
D.保持溫度和容器內壓強不變,充入1molSO3
E.升高溫度F.移動活塞壓縮氣體
(3)某人設想以圖1所示裝置用電化學原理生產硫酸,寫出通入SO2的電極的電極反應式:.
(4)下列關于2SO2(g)+O2(g)?2SO3(g)反應的圖象中,一定正確的是(填序號).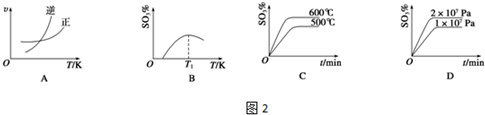
(5)①某溫度下,SO2的平衡轉化率(α)與體系總壓強(p)的關系如圖3所示.當平衡狀態由A變到B時,平衡常數K(A)K(B)(填“>”、“<”或“=”).
②將一定量的SO2(g)和O2(g)放入某固定體積的密閉容器中,在一定條件下,c(SO3)的變化如圖4所示.若在第5分鐘將容器的體積縮小一半后,在第8分鐘達到新的平衡(此時SO3的濃度為0.25mol?L-1).請在圖4畫出此變化過程中SO3(g)濃度的變化曲線.組卷:95引用:3難度:0.3


