2020-2021學年重慶市暨華中學高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題只有一個答案,每題3分,共48分)
-
1.已知2H2S(g)+3O2(g)
2SO2(g)+2H2O(g),若反應速率分別用v(H2S)、v(O2)、v(SO2)、v(H2O)表示,則正確的關系式為( )點燃A.2v(H2S)=3v(O2) B.3v(O2)=2v(H2O) C.3v(O2)=2v(SO2) D.2v(O2)=3v(SO2) 組卷:117引用:6難度:0.8 -
2.中國首條“生態馬路”在上海復興路隧道建成,它運用了“光觸媒”技術,在路面涂上一種光催化劑涂料,可將汽車尾氣中45%的NO和CO轉化成N2和CO2 :2NO+2CO?N2+2CO2 △H<0下列對此反應的敘述中正確的是( )
A.降低溫度能使v(正)增大,v(逆)減小,平衡正向移動,提高反應物的轉化率 B.增大壓強能使該反應的化學平衡常數K增大 C.使用光催化劑能增大NO的轉化率 D.使用光催化劑能增大活化分子的百分數 組卷:102引用:12難度:0.5 -
3.對于可逆反應A(g)+3B(g)?2C(g)+2D(g),在不同條件下的化學反應速率如下,其中表示的反應速率最快的是( )
A.v(A)=0.5 mol?L-1?min-1 B.v(B)=1.2 mol?L-1?s-1 C.v(D)=0.4 mol?L-1?min-1 D.v(C)=0.1 mol?L-1?s-1 組卷:404引用:68難度:0.9 -
4.一定條件下,在密閉容器中進行下列反應:
NO(g)+CO(g)═N2(g)+CO2(g)△H=-373.2kJ?mol-1,達到平衡后,為提高該反應的速率和NO的轉化率,采取的正確措施是( )12A.加催化劑同時升高溫度 B.降低溫度同時增大壓強 C.充入CO D.加催化劑同時增大壓強 組卷:6引用:3難度:0.5 -
5.在密封容器中進行發生如下反應:X2(g)+Y2(g)?2Z(g)已知X2Y2、2的起始濃度分別為0.1mol/L、0.3mol/L、0.2mol/L在一定的條件下,當反應達到平衡時,各物質的濃度有可能是( )
A.Z為0.3mol/L B.Y2為0.35mol/L C.X2為0.2mol/L D.Z為0.4mol/L 組卷:22引用:2難度:0.6 -
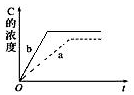 6.已知某可逆反應在密閉容器中進行:A(g)+2B(g)?3C(g)ΔH>0,如圖中曲線a代表一定條件下該反應的過程,若使曲線b變為a曲線,可采取的措施是( )
6.已知某可逆反應在密閉容器中進行:A(g)+2B(g)?3C(g)ΔH>0,如圖中曲線a代表一定條件下該反應的過程,若使曲線b變為a曲線,可采取的措施是( )A.恒溫恒容條件下將A、B的濃度增加一倍 B.恒溫條件下加壓(縮小容器體積) C.恒溫條件下減壓(增大容器體積) D.升高溫度 組卷:7引用:2難度:0.6
二、填空題(本題4個小題,共52分)
-
 19.(1)某可逆反應:2HI(g)?I2(g)+H2(g)在3種不同條件下進行,H2(g)和I2(g)的起始濃度均為0,反應物HI的濃度隨反應時間的變化情況如表:
19.(1)某可逆反應:2HI(g)?I2(g)+H2(g)在3種不同條件下進行,H2(g)和I2(g)的起始濃度均為0,反應物HI的濃度隨反應時間的變化情況如表:
①實驗1中,在10~20min內,以物質HI表示的平均反應速率為
實驗
序號濃度/mol?L-1
時間/min
溫度/℃0 10 20 30 40 50 60 1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50 2 800 1.0 0.60 0.50 0.50 0.50 0.50 0.50 3 950 1.0 0.40 0.25 0.25 0.20 0.20 0.20 ,50min時,v正v逆(填“<”“>”或“=”)。
②0~20min內,實驗2比實驗1的反應速率(填“快”或“慢”),其原因可能是。
③實驗3比實驗1的反應速率(填“快”或“慢”),其原因是。
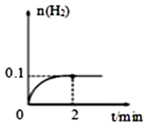
(2)T℃,向1L密閉容器中加入1molHI(g),發生反應2HI?H2+I2,H2物質的量隨時間的變化如圖所示。
①該溫度下,2HI(g)?H2(g)+I2(g)的平衡常數K=。
②相同溫度下,若開始加入HI(g)的物質的量是原來的2倍,則是原來的2倍。
a.平衡常數
b.HI的平衡濃度
b.達到平衡的時間
d.平衡時H2的體積分數組卷:1引用:1難度:0.5 -
20.溫度為T時,向2.0L恒容密閉容器中充入1.0molPCl5,反應PCl5(g)?PCl3(g)+Cl2(g)經過一段時間后達到平衡。反應過程中測定的部分數據見下表,回答下列問題:
(1)反應在前50s—250s內的用PCl5表示平均速率為t/s 0 50 150 250 350 n(PCl3)/mol 0 0.16 0.19 0.20 0.20
(2)該反應的平衡常數K=。
(3)體系平衡時與反應起始時的壓強之比為
(4)其它條件均不變,在上述平衡體系中再加入1.0molPCl5,達到新平衡時n(PCl3)0.4mol(填>,<,=)
(5)相同溫度下,起始時向容器中充入0.6molPCl5、0.20molPCl3和0.20molCl2,反應達到平衡前v(正)v(逆)(填>,<,=)組卷:1引用:1難度:0.6


