2015-2016學(xué)年江西省贛州市信豐中學(xué)高二(上)第二周周考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題有一個(gè)最佳答案,每小題3分,共54分)
-
1.化學(xué)是你,化學(xué)是我,化學(xué)深入我們生活.下列說(shuō)法正確的是( )
A.木材纖維和土豆淀粉遇碘水均顯藍(lán)色 B.包裝用材料聚乙烯和聚氯乙烯都屬于烴 C.食用花生油和雞蛋清都能發(fā)生水解反應(yīng) D.PX項(xiàng)目的主要產(chǎn)品對(duì)二甲苯屬于飽和烴 組卷:29引用:2難度:0.9 -
 2.微生物電池是指在微生物的作用下將化學(xué)能轉(zhuǎn)化為電能的裝置,其工作原理如圖所示。下列有關(guān)微生物電池的說(shuō)法錯(cuò)誤的是( )
2.微生物電池是指在微生物的作用下將化學(xué)能轉(zhuǎn)化為電能的裝置,其工作原理如圖所示。下列有關(guān)微生物電池的說(shuō)法錯(cuò)誤的是( )A.正極反應(yīng)中有CO2生成 B.微生物促進(jìn)了反應(yīng)中電子的轉(zhuǎn)移 C.質(zhì)子通過(guò)交換膜從負(fù)極區(qū)移向正極區(qū) D.電池總反應(yīng)為C6H12O6+6O2═6CO2+6H2O 組卷:1961引用:66難度:0.7 -
3.NA代表阿伏加德羅常數(shù)的值.下列敘述正確的是( )
A.60g丙醇中存在的共價(jià)鍵總數(shù)為10NA B.2.0 O與D2O的混合物中所含中子數(shù)為NAgH182C.標(biāo)準(zhǔn)狀況下,5.6LCO2與足量Na2O2反應(yīng)轉(zhuǎn)移的電子數(shù)為0.5NA D.常溫常壓下,78g苯中含有碳碳雙鍵的數(shù)目為3NA 組卷:8引用:2難度:0.9 -
4.一定條件下,可逆反應(yīng)X(g)+3Y(g)?2Z(g),若X、Y、Z起始濃度分別為c1、c2、c3(均不為0,單位mol/L),當(dāng)達(dá)平衡時(shí)X、Y、Z的濃度分別為0.1mol/L,0.3mol/L,0.08mol/L,則下列判斷不合理的是( )
A.c1:c2=1:3 B.平衡時(shí),Y和Z的生成速率之比為3:2 C.X、Y的轉(zhuǎn)化率不相等 D.c1的取值范圍為0<c1<0.14mol/L 組卷:119引用:42難度:0.7 -
5.已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g)△H=-Q1kJ/mol; 2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol;H2O(g)═H2O(l)△H=-Q3kJ/mol常溫下,取體積比為4:1的甲烷和H2的混合氣體112L(標(biāo)準(zhǔn)狀況下),經(jīng)完全燃燒后恢復(fù)到常溫,則放出的熱量為( )
A.4Q1+0.5Q2+Q3 B.4Q1+Q2+Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3 組卷:12引用:1難度:0.5 -
6.常溫下,下列溶液中各組離子一定能大量共存的是( )
A.加入KSCN顯血紅色的溶液:Na+、NH4+、Cl-、I- B.使紫色石蕊試液變紅的溶液:Fe2+、Mg2+、NO3-、Cl- C.0.1 mol?L-1的NaOH溶液:K+、SiO32-、NO3-、SO42- D.通入足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- 組卷:3引用:2難度:0.7 -
7.下列關(guān)于反應(yīng)過(guò)程中能量變化的說(shuō)法正確的是( )
A. 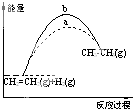
圖中a、b曲線(xiàn)可分別表示反應(yīng)CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化劑時(shí),反應(yīng)過(guò)程中的能量變化B.已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2.則△H1>△H2 C.同溫同壓下,反應(yīng)H2(g)+Cl2(g)=2HCl(g)在光照和點(diǎn)燃條件下的△H不同 D.在一定條件下,某可逆反應(yīng)的△H=+100kJ?mol-1,則該反應(yīng)正反應(yīng)活化能比逆反應(yīng)活化能大100kJ?mol-1 組卷:58引用:14難度:0.9
二、非選擇題(共46分)
-
 20.碳和氮的化合物與人類(lèi)生產(chǎn)、生活密切相關(guān)。
20.碳和氮的化合物與人類(lèi)生產(chǎn)、生活密切相關(guān)。
(1)在一恒溫、恒容密閉容器中發(fā)生反應(yīng):Ni (s)+4CO(g)Ni(CO)4(g),△H<0。50~80℃180~200℃
利用該反應(yīng)可以將粗鎳轉(zhuǎn)化為純度達(dá)99.9%的高純鎳。下列說(shuō)法正確的是(填字母編號(hào))。
A.增加Ni的量可提高CO的轉(zhuǎn)化率,Ni的轉(zhuǎn)化率降低
B.縮小容器容積,平衡右移,△H減小
C.反應(yīng)達(dá)到平衡后,充入CO再次達(dá)到平衡時(shí),CO的體積分?jǐn)?shù)降低
D.當(dāng)4v正[Ni(CO)4]=v正(CO)時(shí)或容器中混合氣體密度不變時(shí),都可說(shuō)明反應(yīng)已達(dá)化學(xué)平衡狀態(tài)
(2)CO與鎳反應(yīng)會(huì)造成含鎳催化劑的中毒。為防止鎳催化劑中毒,工業(yè)上常用SO2將CO氧化,二氧化硫轉(zhuǎn)化為單質(zhì)硫。
已知:CO (g)+O2(g)═CO2(g)△H=-Q1 kJ?mol-112
S(s)+O2(g)═SO2(g)△H=-Q2 kJ?mol-1
則SO2(g)+2CO (g)═S(s)+2CO2(g)△H=。
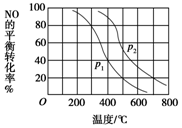
(3)對(duì)于反應(yīng):2NO(g)+O2(g)?2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他條件相同時(shí),分別測(cè)得NO的平衡轉(zhuǎn)化率在不同壓強(qiáng)(P1、P2)下隨溫度變化的曲線(xiàn)(如圖)。
①比較P1、P2的大小關(guān)系:。
②700℃時(shí),在壓強(qiáng)為P2時(shí),假設(shè)容器為1L,則在該條件平衡常數(shù)的數(shù)值為(最簡(jiǎn)分?jǐn)?shù)形式)組卷:0引用:1難度:0.4 -
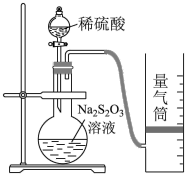 21.化學(xué)反應(yīng)速率是描述化學(xué)反應(yīng)進(jìn)行快慢程度的物理量.下面是某同學(xué)測(cè)定化學(xué)反應(yīng)速率并探究其影響因素的實(shí)驗(yàn).
21.化學(xué)反應(yīng)速率是描述化學(xué)反應(yīng)進(jìn)行快慢程度的物理量.下面是某同學(xué)測(cè)定化學(xué)反應(yīng)速率并探究其影響因素的實(shí)驗(yàn).
Ⅰ.測(cè)定化學(xué)反應(yīng)速率
該同學(xué)利用如圖裝置測(cè)定化學(xué)反應(yīng)速率.
(1)除如圖裝置所示的實(shí)驗(yàn)用品外,還需要的一件實(shí)驗(yàn)用品是.
(2)圓底燒瓶中反應(yīng)現(xiàn)象:溶液變渾濁,并有刺激性氣體產(chǎn)生,寫(xiě)出所發(fā)生反應(yīng)的離子方程式為.
(3)若在2min時(shí)收集到224mL(已折算成標(biāo)準(zhǔn)狀況)氣體,可計(jì)算出該2min內(nèi)H+的反應(yīng)速率,而該測(cè)定值比實(shí)際值偏小,其原因是.
(4)利用該化學(xué)反應(yīng),試簡(jiǎn)述測(cè)定反應(yīng)速率的其他方法:(寫(xiě)一種).Ⅱ.探究化學(xué)反應(yīng)速率的影響因素為探討反應(yīng)物濃度對(duì)化學(xué)反應(yīng)速率的影響,設(shè)計(jì)的實(shí)驗(yàn)方案如下表.(已知 I2+2S2═S4O2-3+2I-,其中Na2S2O3溶液均足量)O2-6
(5)表中Vx=實(shí)驗(yàn)序號(hào) 體積V/mL 時(shí)間/s Na2S2O3溶液 淀粉溶液 碘水 水 ① 10.0 2.0 4.0 0.0 T 1 ② 8.0 2.0 4.0 2.0 T 2 ③ 6.0 2.0 4.0 Vx T3 mL,T1、T2、T3的大小關(guān)系是.組卷:0引用:6難度:0.5


