2021-2022學年吉林省遼源市東豐縣五校高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共25小題,每小題2分,共計50分。在每小題列出的四個選項中,只有一項是符合題目要求的)
-
1.下列過程中,需要加快化學反應速率的是( )
A.鋼鐵生銹 B.塑料降解 C.食物腐敗 D.橡膠老化 組卷:45引用:2難度:0.8 -
2.某反應A+B=C+D 在低溫下能自發進行,在高溫下不能自發進行,對該反應過程△H、△S的判斷正確的是( )
A.△H<0△S>0 B.△H>0△S>0 C.△H<0△S<0 D.△H>0△S<0 組卷:109引用:21難度:0.9 -
3.某原電池總反應為Cu+2Ag+═Cu2++2Ag,該原電池的組成物質中正確的是( )
選項 A B C D 正極 Cu Cu Ag Ag 負極 Ag Ag Cu Cu 電解質溶液 AgNO3 AgCl AgNO3 AgCl A.A B.B C.C D.D 組卷:75引用:2難度:0.9 -
4.已知銀氨溶液中存在如下平衡:[Ag(NH3)2]+?Ag++2NH3。向銀氨溶液中加入或通入少量下列物質,能使上述平衡向正反應方向移動且c(Ag+)減小的是( )
A.KI B.HNO3 C.NH3 D.AgNO3 組卷:14引用:2難度:0.5 -
5.電解與日常生活密切相關,下列符合生產實際的是( )
A.電解熔融的氯化鋁制取金屬鋁 B.在鍍件上鍍鋅時,用鋅作陰極 C.電解法精煉粗銅時,用純銅作陽極 D.電解飽和食鹽水制燒堿時,用涂鎳碳鋼網作陰極 組卷:5引用:3難度:0.7 -
6.室溫下,下列溶液中c(NH4+)最大的是( )
A.0.1mol?L-1的氨水 B.0.1mol?L-1的NH4HSO4溶液 C.0.1mol?L-1的NH4HCO3溶液 D.0.1mol?L-1的NH4NO3溶液 組卷:21引用:2難度:0.7 -
7.已知高爐煉鐵時發生反應Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g) ΔH=-24.6kJ?mol-1,則生成56gFe時,上述反應的能量變化為( )
A.放出8.2kJ能量 B.吸收8.2kJ能量 C.放出12.3kJ能量 D.吸收12.3kJ能量 組卷:3引用:2難度:0.7 -
8.pH相同的氨水、NaOH和Ba(OH)2溶液,分別用蒸餾水稀釋到原來的X、Y、Z倍,稀釋后三種溶液的pH仍然相同,則X、Y、Z的關系是( )
A.X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z 組卷:167引用:5難度:0.6 -
9.已知:①C(s)+O2(g)═CO2(g) ΔH=-393.5kJ?mol-1;
②2CO(g)+O2(g)═2CO2(g) ΔH=-566kJ?mol-1;
③TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g) ΔH=-80kJ?mol-1。
下列說法正確的是( )A.O2的能量大于CO2的能量 B.C和CO2的能量之和等于CO的能量 C.反應①②③均為吸熱反應 D.TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g) ΔH=+141kJ?mol-1 組卷:22引用:2難度:0.5
二、非選擇題(本題共4小題,共50分)
-
28.水溶液中的離子反應與離子平衡在化學工業上有著重要的應用。回答下列問題:
(1)常溫下,將V1mL0.3mol?L-1稀鹽酸與V2mL0.1mol?L-1NaOH溶液混合,所得溶液的pH為1,則V1:V2=(溶液體積變化忽略不計)。
(2)常溫下,將V1mLpH=3的酸HA溶液與V2mLpH=11的NaOH溶液混合。下列說法正確的是(填字母)。
A.若V1=V2,反應后溶液pH一定等于7
B.若反應后溶液呈中性,則混合液中c(H+)+c(OH-)=2×10-7mol?L-1
C.若反應后溶液呈酸性,則V1一定大于V2
D.若反應后溶液呈堿性,則V1一定小于V2
(3)常溫下,用0.1000mol?L-1的NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液,滴定過程中,溶液的pH與消耗NaOH溶液的體積的關系如圖所示: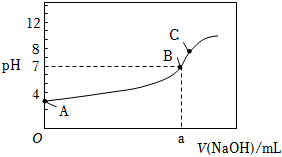
①該滴定過程應該選擇(填“酚酞”或“甲基橙”)作指示劑。
②a(填“>”“<”或“=”)20mL。
③C點溶液中離子濃度由大到小的順序為。
(4)25℃時,下表為一些難溶電解質的相關數據:
常溫下,除去酸性CuCl2溶液中含有的少量FeCl2,其操作步驟為:物質 Fe(OH)2 Cu(OH)2 Fe(OH)3 開始沉淀時的pH 5.8 4.1 2.0 完全沉淀時的pH 8.3 6.4 3.2
①應先加入(填試劑名稱),發生的離子反應方程式為。
②再加入CuO,調節溶液的pH在范圍內,使溶液中的Fe3+轉化為Fe(OH)3沉淀,過濾。組卷:16引用:2難度:0.6 -
 29.維生素C又稱抗壞血酸.其化學式為C6H8O6,在有氧、光照的條件下易被氧化,維生素C含量的測定就是利用其較強的還原性,可以與具有氧化性的物質如I2發生化學反應,把維生素C氧化生成去氫抗壞血酸。維生素C與碘單質的化學反應如下:C6H8O6+I2→C6H6O6+2HI。某實驗小組準確量取稀釋過的市售飲料10.00mL。用已經標定的0.0020mol?L-1的I2溶液進行滴定,記錄所用體積,平行滴定三次。消耗I2溶液體積如下表所示:
29.維生素C又稱抗壞血酸.其化學式為C6H8O6,在有氧、光照的條件下易被氧化,維生素C含量的測定就是利用其較強的還原性,可以與具有氧化性的物質如I2發生化學反應,把維生素C氧化生成去氫抗壞血酸。維生素C與碘單質的化學反應如下:C6H8O6+I2→C6H6O6+2HI。某實驗小組準確量取稀釋過的市售飲料10.00mL。用已經標定的0.0020mol?L-1的I2溶液進行滴定,記錄所用體積,平行滴定三次。消耗I2溶液體積如下表所示:
回答下列問題:實驗編號 待測溶液的體積(mL) 滴定前I2溶液讀數(mL) 滴定后I2溶液讀數(mL) 1 10.00 1.20 13.22 2 10.00 1.21 13.19 3 10.00 2.00 14.00
(1)標準I2溶液應裝入(填“酸式”或“堿式”)滴定管,應選用作指示劑。
(2)如圖表示某次放液后50mL滴定管中液面的位置,如果液面處的讀數是a,則滴定管中液體的體積(填字母)。
A.amL
B.>amL
C.(50-a)mL
D.>(50-a)mL
(3)滴定終點的判斷方法是。
(4)該市售飲料維生素C的濃度為g?L-1。
(5)其他操作均正確,下列操作會導致維生素C測定結果偏低的是(填字母)。
A.錐形瓶中有少量水
B.盛裝標準液的滴定管用蒸餾水清洗后未用標準液潤洗
C.滴定結束時仰視刻度線讀數
D.量取待測液的滴定管沒有潤洗
E.滴定后盛裝標準液的滴定管中有氣泡組卷:8引用:3難度:0.6


