2022-2023學年福建省泉州五中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題只有一個正確答案。1~12題每題2分,13~18題每題3分,共42分)
-
1.下列表述正確的是( )
A.ΔH>0和ΔS>0的反應,在任何溫度下都不能自發進行 B.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ?mol-1可知氫氣燃燒熱ΔH為-571.6kJ?mol-1 C.HCl溶液和NaOH溶液反應的中和熱ΔH=-57.3kJ?mol-1,則含2mol硫酸的稀溶液與足量氫氧化鋇溶液反應放熱為229.2kJ D.已知S(g)+O2(g)=SO2(g) ΔH1<0,S(s)+O2(g)=SO2(g) ΔH2<0,則ΔH1<ΔH2 組卷:11引用:1難度:0.6 -
2.用惰性電極電解足量下列溶液,一段時間后,再加入或通入適量的另一種物質(括號內),溶液組成與原來溶液完全一樣的是( )
A.CuCl2(CuSO4) B.NaOH(NaOH) C.NaCl(HCl) D.CuSO4[Cu(OH)2] 組卷:19引用:1難度:0.7 -
3.為了測定酸堿反應的中和熱,計算時至少需要的數據是( )
①酸溶液的濃度和體積
②堿溶液的濃度和體積
③水的比熱容
④反應后溶液的質量(單位:g)
⑤生成水的物質的量
⑥反應前后溫度變化
⑦操作所需的時間A.③④⑤⑥ B.③④⑤⑦ C.①③⑥ D.全部 組卷:42引用:7難度:0.7 -
4.下列事實能用勒夏特列原理解釋的是( )
A.對CO(g)+NO2(g)?CO2(g)+NO(g)平衡體系,減小體積使壓強增大混合氣體顏色變深 B.氯水中存在下列平衡:Cl2+H2O?HCl+HClO,當加入AgNO3溶液后,溶液顏色變淺 C.多平衡體系,合適的催化劑能提高目標產物的選擇性 D.合成氨工業中溫度選擇400~500℃ 組卷:20引用:5難度:0.7 -
5.可逆反應3H2+N2
2NH3達到平衡狀態時,保持溫度,容器容積不變,向容器中加入一定量的N2,用K表示平衡常數,Q表示濃度商。下列說法正確的是( )催化劑△A.Q減小,K不變,N2的轉化率減小 B.Q不變,K變大,N2的轉化率增大 C.Q不變,K變大,H2的轉化率減小 D.Q增大,K不變,H2的轉化率增大 組卷:36引用:4難度:0.8 -
6.下列說法正確的是( )
A.原電池的兩電極一定是活性不同的金屬 B.鐵片上鍍銅時,電鍍液需含有鍍層金屬陽離子即Cu2+ C.電解精煉銅時,電解質溶液的濃度不變 D.燃料電池能將化學能全部轉化為電能 組卷:8引用:3難度:0.5 -
7.多相催化反應是在催化劑表面通過吸附、解吸過程進行的。我國學者發現T℃時(各物質均為氣態),甲醇與水在銅基催化劑上的反應機理和能量變化如圖所示,下列說法正確的是( )
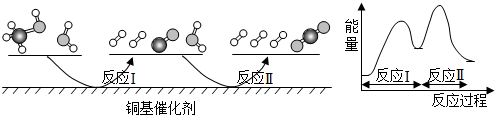
A.反應Ⅱ的熱化學方程式為:CO(g)+H2O(g)=H2(g)+CO2(g) ΔH>0 B.CO(g)在反應中生成又消耗,CO(g)可認為是催化劑 C.選擇優良的催化劑可以降低反應Ⅰ和Ⅱ的活化能,減少過程中的能耗和反應的焓變 D.該條件下1molCH3OH(g)和1molH2O(g)的總能量小于1molCO2(g)和3molH2(g)的總能量 組卷:22引用:1難度:0.7
二、填空題(58分)
-
 22.按照要求回答下列問題。
22.按照要求回答下列問題。
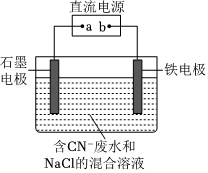
(1)在強堿性條件下用電解法除去發水中的CN-,裝置如圖所示,陽極和陽極區依次發生的反應有:
ⅰ.CN--2e-+2OH-=CNO-+H2O
ⅱ.2Cl--2e-=Cl2↑
ⅲ.3Cl2+2CNO-+8OH-=N2+6Cl-+2+4H2OCO2-3
(1)除去1molCN-,外電路中至少需要轉移mol電子。
(2)為了使電解池連續工作,需要不斷補充NaCl及。
(2)用NaOH溶液吸收煙氣中的SO2,將所得的Na2SO3溶液進行電解,可循環再生NaOH,同時得到H2SO4,其原理如圖所示(電極材料為石墨)。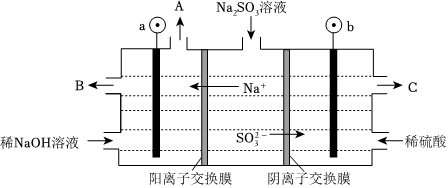
①圖中a極要連接電源的填“正”或“負”)極,C口流出的物質是。
②放電的電極反應式為SO2-3。
(3)用零價鐵(Fe)去除水體中的硝酸鹽()已成為環境修復研究的熱點之一。Fe還原酸性水體中的NO-3的反應原理如圖所示。NO-3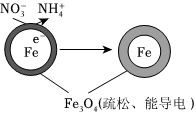
①作負極的物質是。
②正極的電極反應式是。組卷:14引用:1難度:0.6 -
23.Ⅰ.研究氮的氧化物對環境保護有重要意義。
(1)實驗1:在t℃時,無催化劑的恒容容器中,反應2N2O(g)?2N2(g)+O2(g)起始壓強為p0的部分實驗數據如下:
①若N2O起始濃度c0為0.250mol?L-1,則反應至50min時N2O的轉化率α=反應時間/min 0 10 20 30 40 50 60 70 80 90 100 c(N2O)/mol/L 0.10 0.09 0.08 0.07 0.06 0.05 0.04 0.03 0.02 0.01 0.01 。比較不同起始濃度時N2O的分解速率:v(c0=0.250mol?L-1)v(c0=0.100mol?L-1)(填“>”、“=”或“<”)。
②在該溫度下,反應的平衡常數Kp=(體系初始壓強為100kPa,已知氣體分壓=總壓×物質的量分數)。
③不同溫度(T)下,N2O分解一半所需時間隨起始濃度c0的變化關系如圖所示,則T1T2(填“>”、“=”或“<”)。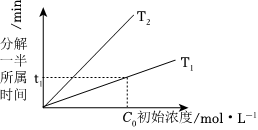
Ⅱ.科學家利用反應對汽車尾氣進行無害化處理,發生如下反應:2CO+2NO?2CO2+N2,CO的平衡轉化率與溫度、起始投料比m的關系如圖所示,圖中起始投料比m=。n(NO)n(CO)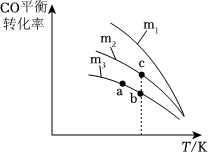
(2)圖中m1與m2大小關系是。
(3)a、b、c三點對應的平衡常數Ka、Kb、Kc相對大小關系是,寫出你的判斷依據:。組卷:1引用:1難度:0.5


