2022-2023學年上海市行知中學高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(40分)
-
1.下列物質熔化時破壞分子間作用力的是( )
A.生石灰 B.冰醋酸 C.水晶 D.食鹽 組卷:70引用:1難度:0.7 -
2.某元素的相對原子質量的計算式為:34.969×75.77%+36.966×24.23%═35.453,下列說法錯誤的是( )
A.該元素有兩種同位素 B.75.77%是某同位素的豐度 C.35.453是該元素的平均相對原子質量 D.36.966表示某同位素的質量數 組卷:28引用:1難度:0.8 -
3.用示意圖或圖示的方法能夠直觀形象地展示化學知識。以下圖示正確的是( )
A. 
B. 
C. 
D.  組卷:11引用:2難度:0.6
組卷:11引用:2難度:0.6 -
4.“酸化”是實驗中經常采用的方法,下列說法正確的是( )
A.提高高錳酸鉀的氧化能力,用稀鹽酸酸化 B.抑制Fe2+的水解,用稀硝酸酸化 C.檢驗某鹵代烴中是否含氯元素,先加HNO3酸化,再加AgNO3溶液檢驗 D.確認溶液中含有SO42-時,先用鹽酸酸化,再加BaCl2溶液檢驗 組卷:7引用:1難度:0.6 -
 5.在催化劑、400℃時可實現氯的循環利用,如圖是其能量關系圖,下列分析正確的是( )
5.在催化劑、400℃時可實現氯的循環利用,如圖是其能量關系圖,下列分析正確的是( )A.曲線a是使用了催化劑的能量變化曲線 B.反應物的總鍵能高于生成物的總鍵能 C.反應的熱化學方程式為:4HCl(g)+O2(g) 2Cl2+2H2O(g)-115.6 kJ催化劑400℃D.若反應生成2mol液態水,放出的熱量高于115.6kJ 組卷:84引用:7難度:0.9 -
6.能證明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事實是( )
A.滴入酚酞溶液變紅,再加入H2SO4溶液紅色褪去 B.滴入酚酞溶液變紅,再加入氯水后紅色褪去 C.滴入酚酞溶液變紅,再加入BaCl2溶液后產生沉淀且紅色褪去 D.滴入甲基橙溶液變黃,再加入氯水后黃色褪去 組卷:34引用:5難度:0.7 -
 7.將1molH2(g)和2molI2(g)置于某2L密閉容器中,在一定溫度下發生如下反應,并達到平衡:H2(g)+I2(g)?2HI(g)+Q(Q>0)。HI的體積分數HI%隨時間變化如曲線(Ⅰ)所示,若改變反應條件,HI%的變化如曲線(Ⅱ)所示,則改變的條件可能是( )
7.將1molH2(g)和2molI2(g)置于某2L密閉容器中,在一定溫度下發生如下反應,并達到平衡:H2(g)+I2(g)?2HI(g)+Q(Q>0)。HI的體積分數HI%隨時間變化如曲線(Ⅰ)所示,若改變反應條件,HI%的變化如曲線(Ⅱ)所示,則改變的條件可能是( )A.恒溫條件下,加入適當催化劑 B.恒溫條件下,縮小反應容器體積 C.恒容條件下升高溫度 D.恒溫條件下,擴大反應容器體積 組卷:224引用:3難度:0.5 -
8.常溫下,一定能大量共存的離子組是( )
A.澄清透明溶液中:K+、Cu2+、Na+、Cl- B.0.5mol/LNaAlO2溶液中:K+、Na+、SO42-、Al3+ C. ═0.1mol/L的溶液中:Na+、K+、HCO3-、NO3-Kw[H+]D.使甲基橙呈紅色的溶液中:I-、Cl-、NO3-、Na+ 組卷:14引用:1難度:0.7
二、(本題共16分)
-
23.對燃煤煙氣和汽車尾氣進行脫硝、脫碳和脫硫等處理,可實現綠色環保、節能減排等目的。汽車尾氣脫硝脫碳的主要原理為:2NO(g)+2CO(g)
N2(g)+2CO2(g)+Q(Q>0)。催化劑
一定條件下,在一密閉容器中,用傳感器測得該反應在不同時間的NO和CO濃度如下表:
(1)寫出該反應的平衡常數表達式時間/s 0 1 2 3 4 5 c(NO)/mol?L-1 1.00×10-4 4.50×10-5 2.50×10-5 1.50×10-5 1.00×10-5 1.00×10-5 c(CO)/mol?L-1 3.60×10-4 3.05×10-4 2.85×10-4 2.75×10-4 2.70×10-4 2.70×10-4 。
(2)前2s內的平均反應速率v(N2)═;達到平衡時,CO的轉化率為。
(3)采用低溫臭氧氧化脫硫脫硝技術,同時吸收SO2和NOx,獲得(NH4)2SO4的稀溶液。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固體,的值將c(NH+4)c(SO2-4)(填“變大”、“不變”或“變小”)。
(4)向BaCl2溶液中通入足量SO2氣體,沒有沉淀生成,繼續滴加一定量的氨水后,生成BaSO3沉淀。用電離平衡原理解釋上述現象。
(5)如圖是Na2SO3溶液中各離子濃度的相對大小關系示意圖。其中,④是。(填微粒符號)
(6)在NaHSO3溶液中各微粒濃度等式關系正確的是。
a.c(Na+)═2c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)+c(H+)═c(SO32-)+c(HSO3-)+c(OH-)
c.c(OH-)+c(SO32-)═c(H+)+c(H2SO3)
d.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)組卷:6引用:1難度:0.6 -
24.碘在生產中有著重要應用,它有一定的氧化性,可以將H2S、H2SO3等氧化;又具有一定的還原性,可以被氧化為碘酸鹽。活性炭吸附法是工業提碘的主要方法之一,其流程如圖:
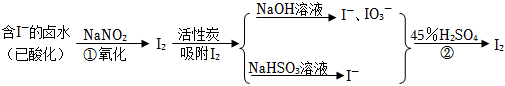
完成下列填空:
(1)酸性條件下,NaNO2溶液只能將I-氧化為I2,同時生成NO。寫出反應①的離子方程式并標出電子轉移的方向和數目。
(2)氯氣、濃硝酸、酸性高錳酸鉀等都是常用的強氧化劑,但工業上氧化鹵水中的I-選擇了價格并不便宜的亞硝酸鈉,可能的原因是。
(3)反應②發生時,溶液底部有紫黑色固體生成,有時溶液上方產生紫色氣體,產生這種現象的原因。
(4)流程中,碘元素經過了I-→I2→I-、IO3-→I2的變化過程,這樣反復操作的目的是。
(5)0.1mol/L的NaHSO3溶液中分別加入以下物質,回答問題:
①加入BaCl2溶液,無明顯現象;若再加入少量NaClO固體,則產生白色沉淀。請結合方程式解釋產生白色沉淀的現象。
②加入少量固體碘單質,溶液的pH(選填:增大、減小、不變),HSO3-的電離平衡移動(選填:向左、向右、不)。
(6)制得的碘單質含有雜質,為測定其純度,進行以下實驗。
①準確稱取碘單質樣品2.210g,加入水和適量KI固體(用以增加碘的溶解度)溶解,配成250mL待測溶液。
②取25.00mL待測液,用0.1000mol/LNa2S2O3標準液滴定(I2+2S2O32-→2I-+S4O62-),以淀粉溶液做指示劑,達到滴定終點時的現象為。
③重復滴定2次,測得Na2S2O3溶液平均值為15.80mL。該產品中I2的純度為。(保留3位小數)組卷:6引用:1難度:0.3


