2020-2021學年山東省濱州市高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題包括10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.下列物質的性質與用途均正確,且具有對應關系的是( )
A.氯氣具有漂白性,可用作自來水消毒劑 B.SO2具有氧化性,可用作食品防腐劑 C.FeCl3溶液呈酸性,可用于刻蝕銅制電路板 D.碳酸氫鈉受熱易分解,可用作食品膨松劑 組卷:12引用:1難度:0.6 -
2.下列化學用語正確的是( )
A.質子數為117、中子數為174的核素Ts: Ts174117B.基態銅原子的價電子排布圖: 
C.HClO的結構式:H-O-Cl D.HSO3-水解的離子方程式:HSO3-+H2O?SO32-+H3O+ 組卷:32引用:1難度:0.8 -
3.下列說法正確的是( )
A.在所有元素中,氟的第一電離能最大 B.金屬離子的電荷越多、半徑越大,金屬晶體的硬度越高 C.石墨轉化為金剛石既有共價鍵的斷裂和生成,也有分子間作用力的破壞 D.鹵素單質、鹵素氫化物、鹵素碳化物(即CX4)的熔、沸點均隨著相對分子質量的增大而升高 組卷:13引用:1難度:0.7 -
4.設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.常溫常壓下,4.4g乙醛所含σ鍵數目為0.7NA B.2.0g H217O與D2O的混合物中所含中子數為NA C.23g鈉在空氣中充分燃燒時,轉移電子數為NA D.密閉容器中充入1mol PCl3與1mol Cl2反應制備PCl5(g),增加2NA個P-Cl鍵 組卷:28引用:1難度:0.6 -
5.下列操作能達到實驗目的的是( )
A. 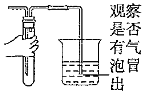
檢驗裝置氣密性B. 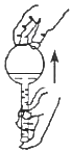
檢查容量瓶是否漏水C. 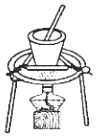
從食鹽溶液中獲得氯化鈉晶體D. 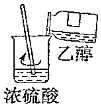
混合濃硫酸和乙醇組卷:49引用:4難度:0.5 -
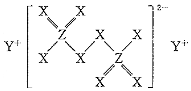 6.短周期主族元素L、X、Y、Z、W的原子序數依次遞增,其中只有一種金屬元素,L和Y、X和Z分別位于同一主族,由X、Y、Z三種元素形成的化合物M結構如圖所示,在工業上可用作漂白劑。下列敘述正確的是( )
6.短周期主族元素L、X、Y、Z、W的原子序數依次遞增,其中只有一種金屬元素,L和Y、X和Z分別位于同一主族,由X、Y、Z三種元素形成的化合物M結構如圖所示,在工業上可用作漂白劑。下列敘述正確的是( )A.元素電負性:X>W>Z B.簡單離子半徑:Z>W>Y>X C.Z、W的氧化物對應的水化物均為強酸 D.X、Z、W分別與L形成的最簡單化合物中W的沸點最高 組卷:25引用:2難度:0.5
三、解答題(共5小題,滿分60分)
-
19.從砷鹽凈化渣(主要成分為Cu、As、Zn、ZnO、Co和SiO2)中回收有利用價值金屬的工藝流程如圖,回答下列問題:
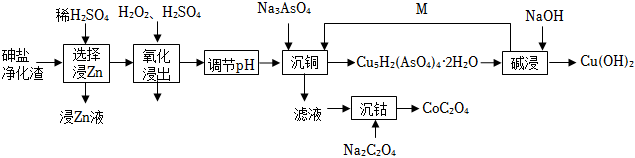
(1)在“選擇浸Zn”之前,將砷鹽凈化渣進行粉碎的目的是。
(2)其他條件不變時,Zn和Co的浸出率隨pH變化如圖所示,則“選擇浸Zn”過程中,最好控制溶液的pH=。從“浸Zn液”中制備ZnSO4?7H2O時需要結晶、過濾、洗滌、烘干,烘干操作需在減壓低溫條件下進行的原因是。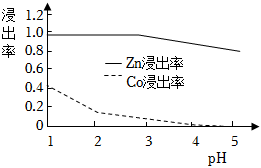
(3)“氧化浸出”時,發生的反應有2As+5H2O2═2H3AsO4+2H2O,另外還有。
(4)循環利用的物質M為。(填名稱)
(5)草酸鈷是制備各種鈷氧化物和鈷粉的重要原料,廣泛應用于磁性材料、電極材料及超硬材料等領域.草酸鈷在惰性氣氛中的熱重分析圖譜表明,350~420℃之間的失重率達59.9%,則該溫度范圍內草酸鈷分解的化學方程式為。組卷:8引用:1難度:0.5 -
20.熱化學碘硫循環可用于大規模制氫氣,SO2水溶液還原I2和HI分解均是其中的主要反應.回答下列問題:
(1)碘硫熱化學循環中,SO2水溶液還原I2的反應包括:SO2+I2+2H2O?3H++HSO4-+2I-、I-+I2?I3-。若起始時n(I2)=n(SO2)=1mol,I-、I3-、H+、HSO4-的物質的量隨起始投料的變化如圖1所示。n(H2O)n(SO2)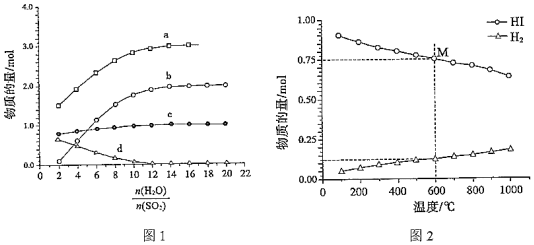
圖中曲線a表示的微粒為H+,b為,c為。
(2)反應HI(g)?H2(g)+12I2(g),起始時HI的物質的量為1mol,起始壓強為0.1MPa,平衡時HI(g)和H2(g)的物質的量隨溫度變化如圖2所示。12
①該反應的△H(填>”或“<”)0。
②600℃時,反應的平衡常數Kp=。(Kp為分壓表示的平衡常數)
(3)只需一步完成的反應稱為基元反應,基元反應aA+dD═gG+hH的速率方程為v=kca(A)?cd(D),其中k為速率常數;非基元反應由多個基元反應組成,其速率方程可由反應機理推定。反應H2(g)+I2(g)?2HI(g)的反應機理如下:
第一步:I22I(快速平衡)k1k-1
第二步:I+H2H2I(快速平衡)k2k-2
第三步:H2I+I2HI(慢反應)k3
①第一步反應(填“放出”或“吸收”)能量。
②H2(g)與I2(g)反應生成HI(g)的速率方程為v=。(用含k1、k-1、k2…的代數式表示)組卷:41引用:1難度:0.5


