2021-2022學年江蘇省南京市中華中學高三(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.化學與社會、生活及工業生產密切相關。下列有關說法正確的是( )
A.“靜電除塵”“燃煤固硫”“汽車尾氣催化凈化”等措施均涉及化學變化 B.海水資源的綜合利用涉及鹽、制取鎂和溴等,其過程中均涉及氧化還原反應 C.“嫦娥五號”著陸器在月面展示的國旗主要材料為國產高性能芳綸纖維,屬于新型無機非金屬材料 D.75%濃度的酒精、含氯消毒劑、過氧乙酸均可以有效滅活新型冠狀病毒 組卷:8引用:3難度:0.7 -
2.光氣(COCl2)是一種重要的有機中間體。反應CHCl3+H2O2=COCl2↑+HCl+H2O可用于制備光氣。下列有關敘述正確的是( )
A.CHCl3為非極性分子 B.H2O2的電子式為 
C.沸點:H2O2>CHCl3 D.COCl2中碳原子的軌道雜化類型為sp3雜化 組卷:12引用:1難度:0.6 -
3.利用下列裝置能達到相應實驗目的的是( )
A. 
用圖裝置測定氯水的pHB. 
用圖裝置保存液溴C. 
用圖裝置制備Fe(OH)2并能較長時間不變色D. 
用圖裝置進行中和滴定組卷:35引用:3難度:0.5 -
4.下列有關物質的性質與用途具有對應關系的是( )
A.碳酸氫鈉水溶液呈堿性,可用于制發酵粉 B.金屬鈉的熔點低,可用于制備鈦、鋯等金屬 C.濃硫酸具有吸水性,可用于干燥氯氣和氯化氫 D.二氧化硫具有還原性,可用于漂白有色物質 組卷:11引用:2難度:0.7 -
5.W、X、Y、Z為原子序數依次增大的短周期主族元素,Y的原子序數等于W與X的原子序數之和,Z的最外層電子數為K層的一半,W與X可形成原子個數比為2:1的18e-分子。下列說法正確的是( )
A.簡單離子半徑:Z>X>Y B.W與Y能形成含有非極性鍵的化合物 C.第一電離能:X<Y D.由W、X、Y三種元素所組成化合物的水溶液均顯酸性 組卷:11引用:1難度:0.6
二、非選擇題:共4題,共58分。
-
 17.工業上常用FeC2O4?2H2O晶體為原料制備K3[Fe(C2O4)3]?3H2O晶體。
17.工業上常用FeC2O4?2H2O晶體為原料制備K3[Fe(C2O4)3]?3H2O晶體。
Ⅰ制備FeC2O4?2H2O晶體
溶解:稱取5.0g(NH4)2Fe(SO4)2晶體,放入儀器A中,加入少量1mol?L-1H2SO4溶液和15mL蒸餾水加熱溶解;
沉淀:向儀器A中加入25mL飽和H2C2O4溶液,加熱攪拌至沸,停止加熱,靜置;產生大量的FeC2O4?2H2O沉淀,過濾,洗滌,得FeC2O4?2H2O晶體。
(1)“溶解”時加入硫酸的目的是。
(2)(NH4)2Fe(SO4)2晶體往往會混有少量Fe3+,影響草酸亞鐵晶體的純度。在酸性條件下,NH2OH可將Fe3+轉化為Fe2+,自身轉化為無毒氣體和水,該反應的離子方程式為。
(3)檢驗沉淀洗滌是否完全的方法是。
Ⅱ制備K3[Fe(C2O4)3]?3H2O晶體
已知:①K2Fe(C2O4)2可溶于水;Fe2(C2O4)3難溶于水;K3[Fe(C2O4)3]?3H2O易溶于水,難溶于乙醇。
②實驗條件下,pH=3.2時,Fe3+沉淀完全;過氧化氫在40℃以上發生顯著分解。
(4)以FeC2O4?2H2O晶體為原料,制備K3[Fe(C2O4)3]?3H2O晶體。請補充完整相應的實驗方案:取一定量的FeC2O4?2H2O晶體,邊加入飽和H2C2O4溶液邊攪拌,至pH約為3,,過濾、洗滌、晾干、得到K3[Fe(C2O4)3]?3H2O晶體。(實驗中須使用的試劑:10%H2O2溶液,飽和K2C2O4溶液,K3[Fe(CN)6]溶液,無水乙醇。)
Ⅲ計算K3[Fe(C2O4)3]?3H2O晶體的純度
(5)某三草酸合鐵酸鉀晶體中含有少量的FeC2O4,為測定其純度,進行如下實驗:
步驟Ⅰ:稱取5.000g三草酸合鐵酸鉀晶體,配制成250mL溶液。
步驟Ⅱ:取25.00mL溶液,用0.1000mol?L-1酸性KMnO4溶液滴定至終點,消耗KMnO4溶液13.50mL。
步驟Ⅲ:另取25.00mL溶液,加入過量銅粉,過濾,洗滌,將濾液和洗滌液合并。
步驟Ⅳ:用0.1000mol?L-1酸性KMnO4溶液滴定合并后的溶液至終點,消耗KMnO4溶液15.50mL。
已知:酸性條件下可氧化Fe2+、C2MnO-4,O2-4被還原成Mn2+。MnO-4
計算該三草酸合鐵酸鉀晶體的純度,寫出計算過程。組卷:14引用:1難度:0.4 -
18.燃煤煙氣中的NOx、SO2經處理后可被吸收。
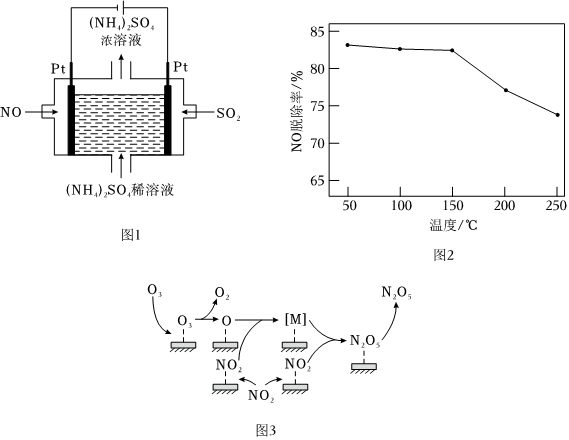
(1)若煙氣主要成分為NO、SO2,可通過電解法除去,其原理如圖1所示。陰極的電極反應式為。電解過程得到產物為。
(2)若煙氣主要成分為NO2、SO2,可通入NaOH溶液將NO2完全轉化為。則NO2、SO2與NaOH反應的離子方程式為NO-2。
(3)O3氧化性強于O2,能更有效地氧化NO。
①2NO(g)+O2(g)═2NO2(g)ΔH1=-114kJ?mol-1
2O3(g)═3O2(g)ΔH2=-284.2kJ?mol-1(活化能Ea=119.2kJ?mol-1)
NO(g)+O3(g)═NO2(g)+O2(g)ΔH3=kJ?mol-1(活化能Ea=3.2kJ?mol-1)
②NO可經O3處理后再用堿液吸收而實現脫除。為分析氧化時溫度對NO脫除率的影響,將NO與O3混合反應一段時間,再用堿液吸收氧化后的氣體。其他條件相同時,NO脫除率隨NO與O3混合反應時溫度變化如圖2所示。溫度在50~150℃時,隨著溫度升高,NO脫除率無明顯變化;溫度超過150℃時,隨著溫度升高,NO脫除率下降。其可能原因是。
(4)用O3氧化NO2時,使用催化劑可提高氧化效率。研究發現NO2在某催化劑表面被O3氧化時反應機理如圖3所示,反應過程中,氮氧化物[M]與NO2按物質的量1:1反應生成N2O5,[M]的化學式為。該催化氧化過程總反應的化學方程式為。組卷:56引用:5難度:0.5


