2021-2022學年河南省駐馬店市確山第二高級中學高三(上)期中化學試卷
發布:2024/8/6 8:0:9
一、選擇題:(本題共20小題,1-15小題,每小題2分,16-20小題,每小題2分,共45分)
-
1.化學與生產、生活、社會密切相關,下列有關說法中正確的是( )
A.預防新型冠狀病毒,可用95%的醫用酒精進行環境消毒 B.明礬溶于水后生成的膠狀物能吸附雜質,可用作凈水劑 C.導航衛星中的計算機芯片材料是高純度的二氧化硅 D.汽車尾氣催化轉化器的使用可以減少溫室氣體的排放 組卷:0引用:2難度:0.7 -
2.下列有關非金屬元素說法正確的是( )
A.二氧化氯具有還原性,可用于自來水的殺菌消毒 B.液氨汽化時要吸收大量的熱,可用作制冷劑 C.硫具有還原性,可用硫粉覆蓋地上灑落的汞 D.硅是重要的半導體材料,常用于制作光導纖維 組卷:9引用:2難度:0.7 -
3.下列對物質的主要用途、原因解釋的描述都正確的是( )
選項 物質 主要用途 原因解釋 A 晶體硅 高純硅可用于制備光導纖維、光電池、集成電路和計算機芯片 硅是良好的半導體材料 B 金屬鋁 高鐵車廂采用鋁合金材料 鋁與氧氣不反應 C 氯氣 與石灰乳或燒堿反應制備消毒劑 氯氣有強氧化性 D 金屬鈉 高溫時能從熔融TiCl4中置換出金屬Ti 鈉具有很強的還原性 A.A B.B C.C D.D 組卷:16引用:6難度:0.7 -
4.鐵及其化合物是中學化學中的一類重要物質,下列關于鐵元素的敘述中正確的是( )
A.保存FeCl2溶液常常加一些鐵粉,其目的是抑制Fe2+水解 B.在25℃時,pH=0的溶液中,Al3+、 、NH+4、Fe2+可以大量共存NO-3C.制備AlCl3、FeCl3均可采用將溶液直接蒸干的方法 D.硫酸亞鐵溶液中加入過氧化氫溶液:2Fe2++H2O2+2H+=2Fe3++2H2O 組卷:7引用:1難度:0.5 -
5.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則正確的關系式為( )
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O) C.4v(O2)=5v(NO) D.2v(NH3)=3v(H2O) 組卷:93引用:12難度:0.7 -
6.廢氣中的H2S通過高溫熱分解可制取氫氣:2H2S(g)?2H2(g)+S2(g),某溫度時,下列不能夠說明H2S的轉化率達到最大值的依據是( )
A.氣體的壓強不發生變化 B.單位時間分解的H2S和生成的H2一樣多 C. 不發生變化c2(H2)?c(S2)c2(H2S)D.氣體的平均相對分子質量不發生變化 組卷:0引用:1難度:0.6 -
7.250℃,101Kpa時,2N2O5(g)=4NO2(g)+O2(g)△H=+56.76kJ/mol,該反應能自發進行,其自發進行的主要原因是( )
A.是吸熱反應 B.是放熱反應 C.是熵減反應 D.熵增效應大于能量效應 組卷:165引用:13難度:0.9 -
8.相同溫度下,根據三種酸的電離常數,下列判斷正確的是( )
酸 HX HY HZ 電離常數K/(mol?L-1) 9×10-7 9×10-6 1×10-2 A.三種酸的強弱關系:HX>HY>HZ B.反應HZ+Y-=HY+Z-能夠發生 C.由電離平衡常數可以判斷,HZ屬于強酸,HX和HY屬于弱酸 D.相同溫度下,1 mol?L-1 HX溶液的電離常數大于0.1 mol?L-1 HX溶液的電離常數 組卷:108引用:12難度:0.5
二、非選擇題(本題共4小題,共55分)
-
23.三氯化六氨合鈷(Ⅲ)([Co(NH3)6]Cl3,鈷為+3價)在鈷化合物的合成中是重要原料。實驗室以CoCl2為原料制備[Co(NH3)6]Cl3,步驟如下:
Ⅰ.CoCl2的制備。
CoCl2可以通過鈷和氯氣反應制得,實驗室制備純凈CoCl2可用如圖實驗裝置實現(已知:鈷單質在300℃以上易被氧氣氧化,CoCl2易潮解)。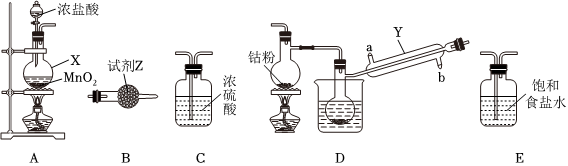
(1)儀器X的名稱為。
(2)X中發生反應的離子方程式為。
(3)裝置的連接順序為A→→B。
Ⅱ.[Co(NH3)6]Cl3的制備。
在100mL錐形瓶內加入4.5g研細的二氯化鈷CoCl2,3gNH4Cl和5mL水,加熱溶解后加入0.3g活性炭作催化劑,冷卻后,通入足量NH3,混合均勻;控制溫度在10℃以下,緩慢加入10mL10%的H2O2,然后加熱至60℃左右,恒溫20分鐘,適當搖動錐形瓶:在冰水中冷卻所得溶液,即有晶體析出(粗產品)。回答下列問題:
(4)該過程中控制溫度為60℃的方法是。
(5)制備[Co(NH3)6]Cl3的總反應化學方程式為。
Ⅲ.測定[Co(NH3)6]Cl3中鈷的含量。
(6)原理:利用Co3+將KI氧化成I2,Co3+被還原后的產物為Co2+。然后用0.015mol?L-1Na2S2O3標準溶液滴定生成的I2,Na2S2O3所得產物為S4。若稱取樣品的質量為0.27g,滴定I2時,達到終點消耗Na2S2O3標準溶液的平均體積為54.00mL。則該氧化還原滴定指示劑為O2-6,該樣品中鈷元素的質量分數為。組卷:10引用:4難度:0.5 -
 24.以黃銅礦(主要成分為鐵、銅、硫三種元素組成的化合物)為基本原料,通過一系列的冶煉可得到銅、鐵、SO2、SO3、H2SO4等物質,回答下列問題:
24.以黃銅礦(主要成分為鐵、銅、硫三種元素組成的化合物)為基本原料,通過一系列的冶煉可得到銅、鐵、SO2、SO3、H2SO4等物質,回答下列問題:
(1)基態鐵原子價層電子排布式為,基態硫原子的核外電子共有種不同的能量。硫元素所在周期的非金屬元素第一電離能由大到小的順序為。
(2)SO2、SO3、H2SO4中,硫原子的雜化軌道類型為sp3的物質是,SO2的分子構型是,屬于非極性分子的氧化物是。
(3)在溶液中Cu2+易與水形成[Cu(H2O)6]2+而顯藍色,向相應的溶液中加入足量的氨水可得到[Cu(NH3)4(H2O)2]2+,則[Cu(NH3)4(H2O)2]2+中Cu2+的配位數是,氧銅配位鍵與氮銅配位鍵相比,較穩定的是。
(4)氧化銅的熔點為1326℃、沸點為1800℃;氧化亞銅的熔點為1235℃、沸點為1100℃,試解釋導致這種差異最可能的原因是。
(5)由鐵、銅、硫形成的某種化合物的晶胞是一個長方體,結構如圖所示,則該化合物的化學式為。若晶體密度為dg?cm-3,則晶胞的高h=pm(寫出簡化后的計算式即可)。組卷:19引用:2難度:0.6


